Giáo án và PPT Hoá học 10 kết nối Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hoá học
Đồng bộ giáo án word và powerpoint (ppt) Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hoá học. Thuộc chương trình Hoá học 10 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét








Giáo án ppt đồng bộ với word









Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
BÀI 8. ĐỊNH LUẬT TUẦN HOÀN. Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
HOẠT ĐỘNG KHỞI ĐỘNG
GV dẫn dắt học sinh tìm hiểu bài:
Hãy dự đoán: Định luật tuần hoàn đóng vai trò như thế nào trong việc dự đoán tính chất của các chất?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1. Định luật tuần hoàn
GV yêu cầu HS dựa vào nhận xét của phần mở đầu và sgk, nêu định luật tuần hoàn.
Sản phẩm dự kiến:
- Tính chất của các nguyên tố và đơn chất cũng như thành phần tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
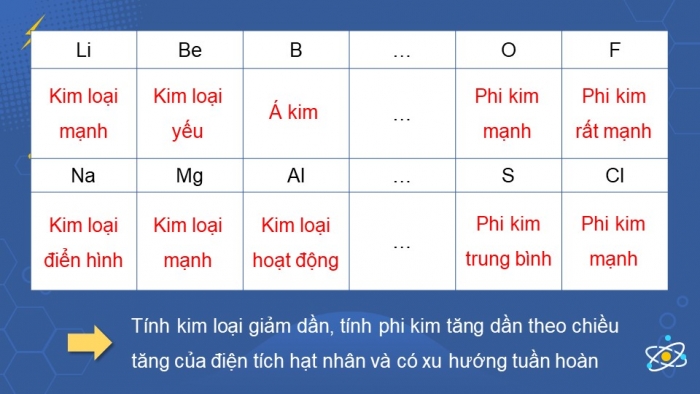
Trả lời câu 1 sgk trang 43:
| Li | Be | B | … | O | F |
| Kim loại mạnh | Kim loại yếu | Á kim | … | Phi kim mạnh | Phi kim rất mạnh |
| Na | Mg | Al | … | S | Cl |
| Kim loại điển hình | Kim loại mạnh | Kim loại hoạt động | … | Phi kim trunh bình | Phi kim mạnh |
=> Tính kim loại giảm dần, tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân và có xu hướng tuần hoàn.
Hoạt động 2. ý nghĩa của bảng tuần hoàn
GV yêu cầu học sinh trao đổi:
Vẽ sơ đồ mối quan hệ của các yếu tố trong bảng tuần hoàn.
Em hãy nêu ý nghĩa của bảng tuần hoàn.
Sản phẩm dự kiến:
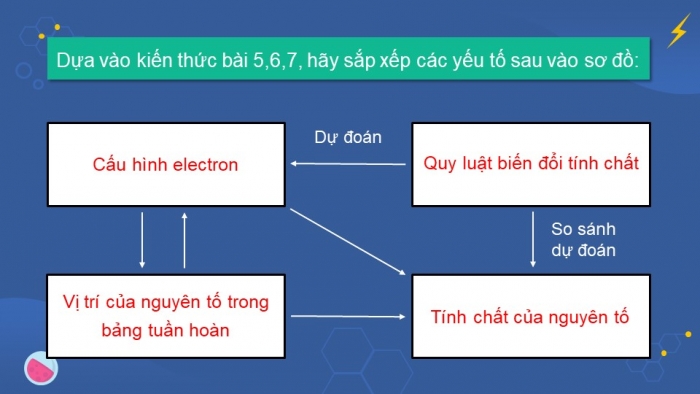
- Sơ đồ mối quan hệ của các yếu tố:

- Ý nghĩa của bảng tuần hoàn: Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron, cấu hình electron nguyên tử quyết định tính chất của các nguyên tố. Vì vậy có thể dự đoán được tính chất hóa học của các nguyên tố khi biết vị trí của nó trong bảng tuần hoàn các nguyên tố hóa học hay cấu hình electron của nó nhờ vào định luật tuần hoàn.
* Ví dụ minh họa:
- VD1: Nguyên tố sunlfu (S) ở ô số 16, nhóm VIA, chu kì 3.
=> Nguyên tử S có:
+ 16 proton, 16 electron.
+ 3 lớp electron.
+ 6 electron lớp ngoài cùng.
Vậy cấu hình electron của S là: 1s22s22p63s23p4.
- VD2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
=> P có: Z =15, P ở ô số 15, chu kì 3, nhóm VA.
- VD3: So sánh tính phi kim của P ( Z = 15) với N ( Z= 7) và S ( Z = 16)
Nguyên tố P và N cùng nhóm nên N có tính phi kim mạnh hơn P, P và S cùng chu kì nên P có tính phi kim yếu hơn S.
- VD4: Nguyên tố có Z= 87, ta có thể dự đoán:
+ Vị trí trong bảng tuần hoàn: Kết thúc chu kì 6 là nguyên tố số 86 nên nguyên tố này thuộc thu kì 7 - nhóm IA.
+ Cấu hình electron: có 87 proton và 87 electron và lớp electron ngoài cùng là lớp thứ 7 có 1 electron: [86Rn] 7s1.
+ Tính chất: ở nhóm IA nên tính chất hóa học của nó là kim loại kiềm và có tính kim loại mạnh nhất vì nằm ở cuối nhóm.
- Trả lời câu hỏi 2 sgk trang 44:
a, Cấu hình electon của 12Mg: 1s22s22p63s2, là kim loại mạnh
Oxide: MgO là basic oxide trung bình, hydroxit Mg(OH)2 là base trung bình
b, Tính kim loại của 11Na > Mg> 13Al và 4Be < Mg < 20Ca.
- Trả lời câu hỏi 3 sgk trang 44:
a, Cấu hình electron là 1s22s22p63s23p64s1
=> K ở ô số 19, chu kì 4, nhóm IA.
b, Đơn chất potassium là kim loại kiềm (nhóm IA) là kim loại mạnh hơn Na và Ca, nhưng yếu hơn Rb. Oxide K2O là basic oxide phản ứng với nước tạo ra hydroxide KOH là base mạnh.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Cho ba nguyên tố X, Y, Z lần lượt ở vị trí 11, 12, 19 của bảng tuần hoàn. Hydroxide của X, Y, Z tương ứng là X’, Y’, Z’.
Thứ tự tang dần tính base của X’, Y’, Z’ là
A. X’ < Y’ < Z’
B. Y’ < X’ < Z’
C. Z’ < Y’ < X’
D. Z’ < X’ < Y’
Câu 2: Yếu tố nào quyết định tính chất hóa học của các nguyên tố?
A. Khối lượng nguyên tử.
B. Cấu hình electron.
C. Số neutron.
D. Số lớp electron.
Câu 3: X và Y là hai nguyên tố thuộc nhóm A, trong cùng một chu kì lớn. Oxide cao nhất của X và Y có công thức hóa học là X2O3 và YO2.
Có các phát biểu sau đây:
X và Y đứng cạnh nhau.
X là kim loại còn Y là phi kim.
Độ âm điện của X nhỏ hơn Y.
Hợp chất của X và Y với hydro lần lượt là XH5 và YH4.
Trong các phát biểu trên, số phát biểu sai là
A. 1
B. 3
C. 2
D. 4
Sản phẩm dự kiến:
Câu 1: B
Câu 2: B
Câu 3: C
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Cấu hình electron nguyên tử của 3 nguyên tố X, Y, T lần lượt là: 1s22s22p63s1, 1s22s22p63s23p64s1, 1s22s22p63s23p1. Sắp xếp theo chiều tăng dần tính kim loại.
Câu 2: A là hỗn hợp 2 kim loại kiềm X và Y thuộc 2 chu kì kế tiếp. Nếu cho A tác dụng vừa đủ với dung dịch HCl thì thu được a gam 2 muối, còn nếu cho A tác dụng vừa đủ với dung dịch H2SO4 thì thu được 1,1807a gam 2 muối. Xác định X và Y.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 KẾT NỐI TRI THỨC
Giáo án Hoá học 10 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 10 kết nối tri thức
Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
Trò chơi khởi động Hoá học 10 kết nối tri thức
Video AI khởi động Hoá học 10 kết nối tri thức hấp dẫn
Trắc nghiệm Hóa học 10 kết nối tri thức
Đề thi hóa học 10 kết nối tri thức
File word đáp án hóa học 10 kết nối tri thức
Bài tập file word Hóa học 10 kết nối tri thức
Kiến thức trọng tâm hóa học 10 kết nối tri thức
Câu hỏi tự luận Hóa học 10 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 10 kết nối tri thức
Phiếu học tập theo bài Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CHÂN TRỜI SÁNG TẠO
Giáo án Hoá học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 10 chân trời sáng tạo
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
Trò chơi khởi động Hoá học 10 chân trời sáng tạo
Video AI khởi động Hoá học 10 chân trời sáng tạo hấp dẫn
Trắc nghiệm hoá học 10 chân trời sáng tạo
Đề thi hóa học 10 chân trời sáng tạo
File word đáp án hóa học 10 chân trời sáng tạo
Bài tập file word Hóa học 10 chân trời sáng tạo
Kiến thức trọng tâm hóa học 10 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CÁNH DIỀU
Giáo án Hoá học 10 cánh diều đủ cả năm
Giáo án điện tử hoá học 10 cánh diều
Giáo án chuyên đề Hóa học 10 cánh diều đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 cánh diều
Trò chơi khởi động Hoá học 10 cánh diều
Video AI khởi động Hoá học 10 cánh diều hấp dẫn
Trắc nghiệm hoá học 10 cánh diều
Đề thi hóa học 10 cánh diều
File word đáp án hóa học 10 cánh diều
Bài tập file word Hóa học 10 cánh diều
Kiến thức trọng tâm hóa học 10 cánh diều
Đề kiểm tra 15 phút Hoá học 10 cánh diều
Phiếu học tập theo bài Hoá học 10 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 10 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều cả năm
