Giáo án và PPT Hoá học 10 kết nối Bài 4: Ôn tập chương 1
Đồng bộ giáo án word và powerpoint (ppt) Bài 4: Ôn tập chương 1. Thuộc chương trình Hoá học 10 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word









Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
BÀI 4. ÔN TẬP CHƯƠNG 1
HOẠT ĐỘNG KHỞI ĐỘNG
Giáo viên hướng dẫn nhanh luật chơi và đưa ra các câu hỏi trong trò chơi:
Các câu hỏi hàng ngang:
Câu 1: Hạt mang điện tích dương trong nguyên tử? (6 chữ cái)
Câu 2: Các nguyên tử có cùng số proton nhưng có số neutron khác nhau gọi là gì? (6 chữ cái)
Câu 3: Trong nguyên tử, hạt không mang điện tích là hạt gì? (7 chữ cái)
Câu 4: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau là nội dung theo nguyên lí nào? (12 chữ)
Câu 5: Trong nguyên tử, hạt mang điện tích âm là? (8 chữ cái)
Câu 6: Các electron phân bố trên orbital sao cho số lượng electron độc thân tối đa và có chiều tự quay giống nhau là nội dung của quy tắc nào? (4 chữ cái)
Câu 7: Khu vực xung quanh hạt nhân mà tại đó xác suất có mặt electron là lớn nhất. (7 chữ cái)
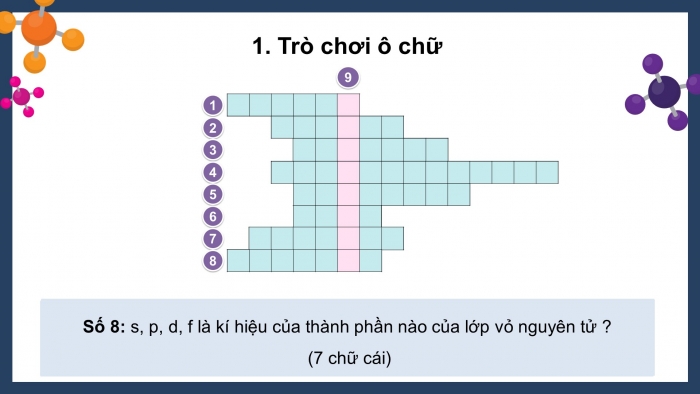
Câu 8: s, p, d, f là kí hiệu của yếu tố nào ở lớp vỏ nguyên tử? (7 chữ cái)
HS tìm ra từ khóa cột dọc để hoàn thành trò chơi.
HỆ THỐNG HÓA KIẾN THỨC
GV cho học sinh thực hiện hệ thống lại kiến thức đã học trong chương 1 SGK.
Hoàn thành sơ đồ hệ thống hóa kiến thức trang 26 Hóa học lớp 10.
Sản phẩm dự kiến:
| Hạt neutron | Hạt proton | Hạt electron |
Khối lượng | 1,675.10–27 kg | 1,673.10–27 kg | 9,109.10–31 kg |
Điện tích | 0 | +1 | -1 |
- Nguyên tử có kích thước: vô cùng nhỏ bé, khối lượng: me + mp + mn; Z = số proton = số electron.
- AO s có dạng hình cầu; AO p gồm AO px, AO py, AO pz; AO p có dạng hình số 8 nổi.
n | 1 | 2 | 3 | 4 |
Lớp electron | K | L | M | N |
Phân lớp | 1s | 2s và 2p | 3s, 3p và 3d | 4s, 4p, 4d và 4f |
Số AO | 1 | 4 | 9 | 16 |
Số electron tối đa | 2 | 8 | 18 | 32 |
- Thứ tự năng lượng các phân lớp từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
- Cấu hình electron:
Đặc điểm của lớp electron ngoài cùng | ||||
Số electron | 1, 2, 3 | 4 | 5, 6, 7 | 8 |
Loại nguyên tố | Kim loại (trừ H, He, B) | Kim loại hoặc phi kim | Thường là phi kim | Khí hiếm |
+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao
+ Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
+ Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
- Nguyên tố hóa học:
+ Số khối (A) = Z + số neutron
+ Kí hiệu nguyên tử:
+ Đồng vị ba
XXab và daXXad => ¯¯¯A=b.x1+d.x2x1+x2A¯=b.x1+d.x2x1+x2 với x1 và x2 lần lượt là phần trăm số nguyên tử của 2 đồng vị.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Biểu thức nào sau đây không đúng?
A. A = Z + N.
B. E = P.
C. Z = A - N.
D. Z = E = N
Câu 2: Các đồng vị của cùng một nguyên tố hóa học có cùng
A. số neutron.
B. Số proton.
C. số khối.
D. số hạt mang điện.
Câu 3: Cấu hình electron nguyên tử của Fe2+ (Z = 26) là
A. [Ar]3d64s2.
B. [Ne]3d6.
C. [Ar]3d6.
D. [Ne]3d54s1.
Câu 4: Số loại phân tử HCl được hình thành từ 3 đồng vị và 2 đồng vị là
A. 3.
B. 4.
C. 5.
D. 6.
Câu 5: Cấu hình electron lớp ngoài cùng của Cl (Z = 17) là
A. 2s22p3.
B. 3s23p5.
C. 3s23p3.
D. 2s22p5.
Sản phẩm dự kiến:
Câu 1: D
Câu 2: B
Câu 3: C
Câu 4: D
Câu 5: B
HOẠT ĐỘNG VẬN DỤNG
Câu 1: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6. Tính tổng số hạt mang điện trong nguyên tử R.
Câu 2: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại nào?
Câu 3: Cho biết ZFe = 26, ZAl = 13. Viết cấu hình electron của ion Al3+ và Fe2+.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 KẾT NỐI TRI THỨC
Giáo án Hoá học 10 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 10 kết nối tri thức
Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
Trò chơi khởi động Hoá học 10 kết nối tri thức
Video AI khởi động Hoá học 10 kết nối tri thức hấp dẫn
Trắc nghiệm Hóa học 10 kết nối tri thức
Đề thi hóa học 10 kết nối tri thức
File word đáp án hóa học 10 kết nối tri thức
Bài tập file word Hóa học 10 kết nối tri thức
Kiến thức trọng tâm hóa học 10 kết nối tri thức
Câu hỏi tự luận Hóa học 10 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 10 kết nối tri thức
Phiếu học tập theo bài Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CHÂN TRỜI SÁNG TẠO
Soạn giáo án Hoá học 10 chân trời sáng tạo theo công văn mới nhất
Giáo án điện tử hoá học 10 chân trời sáng tạo
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
Trò chơi khởi động Hoá học 10 chân trời sáng tạo
Video AI khởi động Hoá học 10 chân trời sáng tạo hấp dẫn
Trắc nghiệm hoá học 10 chân trời sáng tạo
Đề thi hóa học 10 chân trời sáng tạo
File word đáp án hóa học 10 chân trời sáng tạo
Bài tập file word Hóa học 10 chân trời sáng tạo
Kiến thức trọng tâm hóa học 10 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CÁNH DIỀU
Soạn giáo án Hoá học 10 cánh diều theo công văn mới nhất
Giáo án điện tử hoá học 10 cánh diều
Giáo án chuyên đề Hóa học 10 cánh diều đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 cánh diều
Trò chơi khởi động Hoá học 10 cánh diều
Video AI khởi động Hoá học 10 cánh diều hấp dẫn
Trắc nghiệm hoá học 10 cánh diều
Đề thi hóa học 10 cánh diều
File word đáp án hóa học 10 cánh diều
Bài tập file word Hóa học 10 cánh diều
Kiến thức trọng tâm hóa học 10 cánh diều
Đề kiểm tra 15 phút Hoá học 10 cánh diều
Phiếu học tập theo bài Hoá học 10 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 10 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều cả năm
