Giáo án chuyên đề hoá học 10 kết nối bài 3: Năng lượng hoạt hoá của phản ứng hoá học
Giáo án chuyên đề bài 3: Năng lượng hoạt hoá của phản ứng hoá học sách chuyên đề học tập hoá học 10 kết nối. Giáo án chuyên đề bản word, trình bày rõ ràng cụ thể giúp giáo viên hướng dẫn học sinh mở rộng kiến thức sinh học phổ thông, phát triển năng lực, nâng cao khả năng định hướng nghệ nghiệp sau này. Thao tác tải về rất đơn giản, mời quý thầy cô tham khảo
Xem: => Giáo án hóa học 10 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét







Xem video về mẫu Giáo án chuyên đề hoá học 10 kết nối bài 3: Năng lượng hoạt hoá của phản ứng hoá học
Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 3: NĂNG LƯỢNG HOẠT HÓA CỦA PHẢN ỨNG HÓA HỌC
- MỤC TIÊU:
- Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
- Trình bày được khái niệm năng lượng hoạt hoá (theo khía cạnh ảnh hưởng đến tốc độ phản ứng).
- Nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông qua phương trình Arrhenius: .
- Giải thích được vai trò của chất xúc tác.
- Năng lực
- Năng lực chung:
- Năng lực tự chủ và tự học trong tìm tòi khám phá
- Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm
- Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
Năng lực riêng:
- Rèn luyện năng lực sử dụng ngôn ngữ hóa học, nhận thức hóa học, tìm hiểu tự nhiên dưới góc độ hóa học, năng lực vận dụng kiến thức kĩ năng đã học.
- Phẩm chất
- Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
- THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Đối với GV: SGK, Tài liệu giảng dạy, giáo án, đồ dùng dạy học.
- Đối với HS: SGK, SBT, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
- a) Mục tiêu:
- HS được gợi mở về bài học.
- b) Nội dung: HS đọc tình huống mở đầu, suy nghĩ trả lời câu hỏi.
- c) Sản phẩm: HS trả lời được câu hỏi mở đầu.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV yêu cầu HS trả lời câu hỏi:
Hydrogen và oxygen không phản ứng với nhau ở nhiệt độ thường, nhưng khi đưa một ít bột platinium (Pt) vào hỗn hợp hai khí đó, phản ứng xảy ra ngay tức khắc, tạo thành nước. Yếu tố nào quyết định sự thay đổi đó?
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm đôi hoàn thành yêu cầu.
Bước 3: Báo cáo, thảo luận: GV gọi một số HS trả lời, HS khác nhận xét, bổ sung.
Bước 4: Kết luận, nhận định: GV đánh giá kết quả của HS, trên cơ sở đó dẫn dắt HS vào bài học mới.
- HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Năng lượng hoạt hóa
- a) Mục tiêu:
- Trình bày được khái niệm năng lượng hoạt hoá (theo khía cạnh ảnh hưởng đến tốc độ phản ứng).
- Nêu được ảnh hưởng của năng lượng hoạt hoá và nhiệt độ tới tốc độ phản ứng thông qua phương trình Arrhenius: .
- b) Nội dung:
HS đọc SGK, nghe giảng, thực hiện các nhiệm vụ được giao, suy nghĩ trả lời câu hỏi, đọc hiểu Ví dụ.
- c) Sản phẩm: HS hình thành được kiến thức bài học, nêu được về năng lượng hoạt hóa và các yếu tố ảnh hưởng, vận dụng phương trình Arrhenius trong các bài toán.
- d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS | SẢN PHẨM DỰ KIẾN |
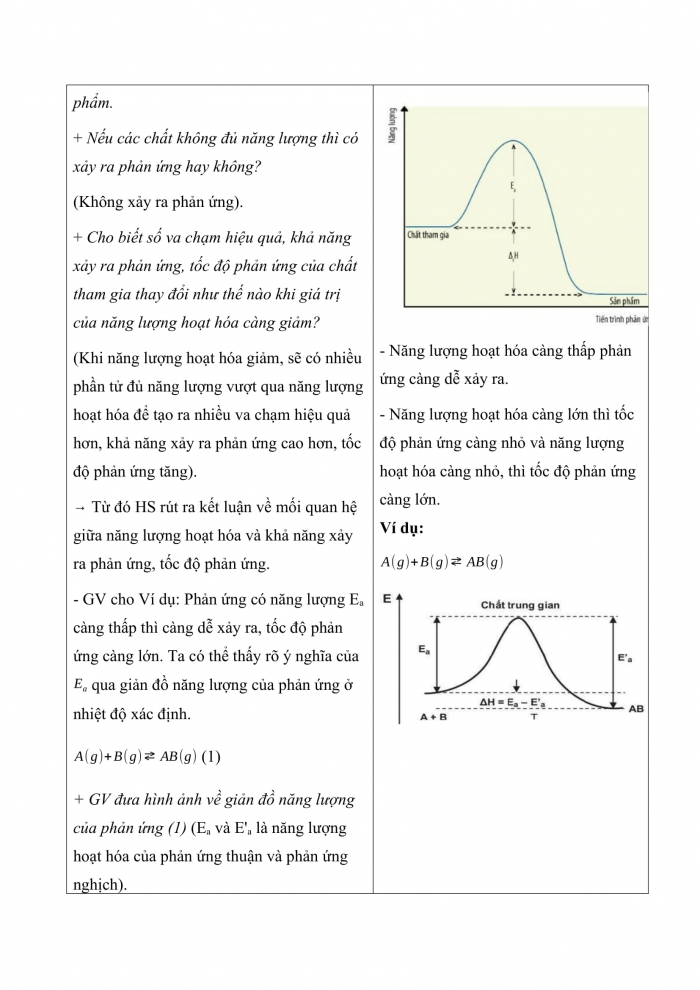
Bước 1: Chuyển giao nhiệm vụ: Nhiệm vụ 1: Tìm hiểu khái niệm năng lượng hoạt hóa - GV cho HS tìm hiểu nội dung SGK, hướng dẫn HS: + Năng lượng hoạt hóa là gì? + GV giới thiệu: để xảy ra phản ứng hóa học, các chất phản ứng phải va chạm với nhau. + Va chạm có hiệu quả là những va chạm đúng hướng và đủ năng lượng để tạo ra sản phẩm. + Nếu các chất không đủ năng lượng thì có xảy ra phản ứng hay không? (Không xảy ra phản ứng). + Cho biết số va chạm hiệu quả, khả năng xảy ra phản ứng, tốc độ phản ứng của chất tham gia thay đổi như thế nào khi giá trị của năng lượng hoạt hóa càng giảm? (Khi năng lượng hoạt hóa giảm, sẽ có nhiều phần tử đủ năng lượng vượt qua năng lượng hoạt hóa để tạo ra nhiều va chạm hiệu quả hơn, khả năng xảy ra phản ứng cao hơn, tốc độ phản ứng tăng). Từ đó HS rút ra kết luận về mối quan hệ giữa năng lượng hoạt hóa và khả năng xảy ra phản ứng, tốc độ phản ứng. - GV cho Ví dụ: Phản ứng có năng lượng Ea càng thấp thì càng dễ xảy ra, tốc độ phản ứng càng lớn. Ta có thể thấy rõ ý nghĩa của qua giản đồ năng lượng của phản ứng ở nhiệt độ xác định. (1) + GV đưa hình ảnh về giản đồ năng lượng của phản ứng (1) (Ea và E'a là năng lượng hoạt hóa của phản ứng thuận và phản ứng nghịch). + Hiệu là hiệu ưng nhiệt của phản ứng thuận, và là hàng rào thế năng mà các phân tử tham gia phản ứng phải vượt qua để tạo thành các sản phẩm phản ứng. Nhiệm vụ 2: Tìm hiểu ảnh hưởng của năng lượng hoạt hóa và nhiệt độ tới tốc độ phản ứng - GV giới thiệu HS các công thức về mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng + Dựa vào phương trình Arrhenius, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng? (Theo phương trình, trong cùng một phản ứng Ea không đổi, hằng số A và R không đổi, khi tăng nhiệt độ, dẫn đến hằng số tốc độ k của phản ứng tăng, nên tốc độ phản ứng tăng). Ví dụ: Một phản ứng đơn giản xảy ra ở nhiệt độ 100oC, trong điều kiện có xúc tác và không có xúc tác, năng lượng hoạt hóa của phản ứng lần lượt là: Ea1=25 kJ/mol, Ea2=50 kJ/mol. So sánh tốc độ phản ứng trong 2 điều kiện. - HS đọc Ví dụ (SGK -tr20): Với phản ứng có năng lượng hoạt hóa Ea= 79 kJ/mol, khi tăng nhiệt độ từ 300 K đến 400 K, tốc độ phản ứng sẽ thay đổi như thế nào? - HS thảo luận nhóm đôi, thực hiện Câu hỏi 1. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu. - GV gợi ý, hướng dẫn. Bước 3: Báo cáo, thảo luận: - HS giơ tay phát biểu, lên bảng trình bày - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. | I. Năng lượng hoạt hóa 1. Khái niệm năng lượng hoạt hóa - Năng lượng hoạt hóa (Ea) là năng lượng tối thiểu mà các chất phản ứng cần có để phản ứng hóa học có thể xảy ra. - Quá trình biến đổi năng lượng trong phản ứng. - Năng lượng hoạt hóa càng thấp phản ứng càng dễ xảy ra. - Năng lượng hoạt hóa càng lớn thì tốc độ phản ứng càng nhỏ và năng lượng hoạt hóa càng nhỏ, thì tốc độ phản ứng càng lớn.
2. Ảnh hưởng của năng lượng hoạt hóa và nhiệt độ tới tốc độ phản ứng - Phương trình Arrhenius: Trong đó: A: hằng số đặc trưng cho mỗi phản ứng. e = 2,7183; R là hằng số lí tưởng (R =8,324 J/(mol.K)); T: nhiệt độ (theo thang Kelvin); Ea: năng lượng hoạt hóa (J/mol). Hoặc: Tại nhiệt độ T1 và T2 tương ứng với hằng số tốc độ và Ví dụ 1: Ở nhiệt độ không đổi, năng lượng hoạt hóa của phản ứng trong 2 điều kiện là: Ea1=25 kJ/mol, Ea2=50 kJ/mol. Phương trình Arrhenius viết cho phản ứng trên trong 2 điều kiện: Vậy khi năng lượng hoạt hóa giảm từ 50 kJ/mol về 25 kJ/mol, tốc độ phản ứng tăng 3170,4 lần. Ví dụ (SGK -tr20) Câu hỏi 1: |
Hoạt động 2: Chất xúc tác
- a) Mục tiêu:
- Giải thích được vai trò của chất xúc tác.
- b) Nội dung: HS đọc SGK để tìm hiểu nội dung kiến thức theo yêu cầu của GV, chú ý nghe giảng, thực hiện nhiệm vụ được giao.
- c) Sản phẩm: HS hình thành kiến thức bài học, giải thích được vai trò của chất xúc tác, đặc điểm.
- d) Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GV VÀ HS | SẢN PHẨM DỰ KIẾN |
Bước 1: Chuyển giao nhiệm vụ: - GV giới thiệu về một phương trình phản ứng của chất xúc tác. - GV đặt câu hỏi: + Thế nào là chất xúc tác. Cho ví dụ về chất xúc tác. - GV đặt câu hỏi để dẫn đến kiến thức về đặc điểm của chất xúc tác. + GV hướng dẫn HS về hình 3.1, quan sát và so sánh năng lượng hoạt hóa của phản ứng sẽ thay đổi như thế nào so với khi không có chất xúc tác và khi có chất xúc tác. (Năng lượng hoạt hóa khi có chất xúc tác sẽ thấp hơn). + Nếu năng lương hoạt hóa giảm thì tốc độ phản ứng sẽ như thế nào? (Tốc độ tăng). + Có phải mỗi chất xúc tác đều có thể sử dụng cho nhiều phản ứng khác nhau hay không? (Không) + Hãy lấy ví dụ chứng minh tính chọn lọc của chất xúc tác. - GV đặt câu hỏi về vai trò của chất xúc tác: + Tìm hiểu SGK hãy nêu các vai trò của chất xúc tác và ví dụ. + Nếu có chất xúc tác thì phương trình Arrhenius như thế nào? - GV chốt kiến thức, cho HS đọc hiểu và phân tích Ví dụ SGK. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức, hoàn thành các yêu cầu, hoạt động cặp đôi, kiểm tra chéo đáp án. - GV: quan sát và trợ giúp HS. Bước 3: Báo cáo, thảo luận: - HS giơ tay phát biểu, lên bảng trình bày - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. | II. Chất xúc tác 1. Khái niệm chất xúc tác Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị biến đổi về chất và lượng sau phản ứng. Ví dụ 1 (SGK -tr20) Ví dụ 2 (SGK -tr20) 2. Đặc điểm của chất xúc tác - Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng. - Chất xúc tác làm tăng tốc độ phản ứng và không làm thay đổi chiều của phản ứng hóa học. - Chất xúc tác có tính chọn lọc. Ví dụ (SGK -tr21). 3. Vai trò của chất xúc tác - Làm tăng tốc độ phản ứng. Ví dụ: Pt, V2O5 được sử dụng trong quá trình oxi hóa SO2 thành SO3. - Quy trình sản xuất có thể được cải tiến bằng cách lựa chọn các chất xúc tác thích hợp. Ví dụ: Tùy thuộc vào chất xúc tác được chọn và điều kiện phản ứng sẽ thu được sản phẩm khác nhau.
- Kí hiệu hằng số tốc độ của phản ứng không có xúc tác là ko và phản ứng có xúc tác là kx. Phương trình Arrhenius: và . Ví dụ (SGK -tr22) |
- HOẠT ĐỘNG LUYỆN TẬP
- a) Mục tiêu: Học sinh củng cố lại kiến thức đã học.
- b) Nội dung: HS vận dụng các kiến thức của bài học làm Câu hỏi 2, 3 (SGK -tr20), 5 (SGK -tr22).
- c) Sản phẩm học tập: HS giải được bài về năng lượng hoạt hóa và chất xúc tác.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV tổng hợp các kiến thức cần ghi nhớ cho HS.
- GV tổ chức cho HS hoạt động theo nhóm làm Câu hỏi 2, 3 (SGK -tr20), 5 (SGK -tr22).
Bước 2: Thực hiện nhiệm vụ: HS quan sát và chú ý lắng nghe, thảo luận nhóm, hoàn thành các bài tập GV yêu cầu.
- GV quan sát và hỗ trợ.
Bước 3: Báo cáo, thảo luận:
- Mỗi bài tập GV mời HS trình bày. Các HS khác chú ý chữa bài, theo dõi nhận xét bài trên bảng.
Bước 4: Kết luận, nhận định:
- GV chữa bài, chốt đáp án, tuyên dương các hoạt động tốt, nhanh và chính xác.
Kết quả:
Câu hỏi 2:
.
Câu hỏi 3:
Câu hỏi 5:
và
Chất xúc tác làm tăng tốc độ phản ứng lên 678,58 lần.
- HOẠT ĐỘNG VẬN DỤNG
- a) Mục tiêu:
- Học sinh thực hiện làm bài tập vận dụng để nắm vững kiến thức.
- b) Nội dung: HS sử dụng SGK và vận dụng kiến thức đã học để làm bài tập.
- c) Sản phẩm: HS vận dụng kiến thức đã học giải quyết bài tập về năng lượng hoạt hóa và chất xúc tác.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- GV yêu cầu HS hoạt động hoàn thành bài tập làm Câu hỏi 4 (SGK-tr22).
- HS làm bài tập thêm:
Bài 1: Cho hằng số tốc độ của một phản ứng là 11 M-1.s-1 tại nhiệt độ 345 K và hằng số thực nghiệm Arrhenius là 20 M-1.s-1. Tính năng lượng hoạt hóa của phản ứng trên.
Bước 2: Thực hiện nhiệm vụ
- HS suy nghĩ, trao đổi, thảo luận thực hiện nhiệm vụ.
- GV điều hành, quan sát, hỗ trợ.
Bước 3: Báo cáo, thảo luận
- Bài tập: đại diện HS trình bày kết quả thảo luận, các HS khác theo dõi, đưa ý kiến.
Bước 4: Kết luận, nhận định
- GV nhận xét, đánh giá, đưa ra đáp án đúng, chú ý các lỗi sai của học sinh hay mắc phải.
Đáp án:
Câu hỏi 4:
Quan sát phương trình hoá học biểu diễn các giai đoạn phản ứng thấy là chất không mất đi trong phản ứng nên nó là chất xúc tác của quá trình phá huỷ tầng ozon.
Bài thêm:
Bài 1:
Phương trình kinh nghiệm Arrhenius:
* HƯỚNG DẪN VỀ NHÀ
- Ghi nhớ kiến thức trong bài.
- Hoàn thành các bài tập trong SBT
- Chuẩn bị bài mới "Bài 4: Entropy và biến thiên năng lượng tự do Gibbs"
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
