Giáo án điện tử Hoá học 11 cánh diều Bài 5: Một số hợp chất quan trọng của nitrogen (P1)
Bài giảng điện tử Hoá học 11 cánh diều. Giáo án powerpoint Bài 5: Một số hợp chất quan trọng của nitrogen (P1). Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt, tạo hứng thú học tập cho học sinh. Thầy, cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 11 cánh diều
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét











Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 11 cánh diều
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
Trong các ao tù có thể tích tụ lượng đáng kể ion ammonium. Có thể nhận biết sự có mặt của ion ammonium trong các ao tù bằng những cách nào? Giải thích.
BÀI 6. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA NITROGEN
NỘI DUNG BÀI HỌC
Ammonia
Muối ammonium
Nguồn gốc một số oxide của nitrogen trong không khí – mưa acid
Nitric acid
Hiện tượng phú dưỡng
- AMMONIA
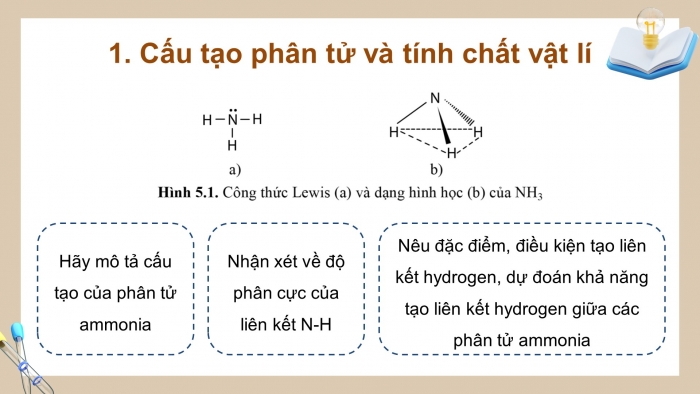
- Cấu tạo phân tử và tính chất vật lí
Hãy mô tả cấu tạo của phân tử ammonia
Nhận xét về độ phân cực của liên kết N-H
Nêu đặc điểm, điều kiện tạo liên kết hydrogen, dự đoán khả năng tạo liên kết hydrogen giữa các phân tử ammonia
Công thức Lewis và dạng hình học (hình chóp tam giác) của phân tử NH3 được thể hiện ở Hình 5.1
- Cấu tạo phân tử và tính chất vật lí
Quan sát video thí nghiệm về tính tan của ammonia trong nước:
Thảo luận, nghiên cứu SGK và trả lời câu hỏi:
Câu 1. Giải thích nguyên nhân ammonia dễ tan trong nước.
Câu 2. Dự đoán tính base, tính khử và tính tan của chất này.
Câu 3. Ở điều kiện thường, ammoniac có tính chất gì?
- Các liên kết N – H là liên kết cộng hóa trị phân cực nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước.
- Ammonia tan nhiều trong nước.
- Ở điều kiện thường, ammonia là chất khí không màu, có mùi khai, xốc và độc.
- Tính chất hoá học
HOẠT ĐỘNG NHÓM
Minh họa các tính chất base và khử của ammonia bằng phương trình hóa học
Cho biết ammonia thể hiện tính chất gì trong phản ứng với acid và oxygen
- Tính base
- Cặp electron hóa trị riêng trên nguyên tử nitrogen là nguyên nhân gây nên tính base của ammonia:
- Khí ammonia hoặc dung dịch ammonia phản ứng với các acid tạo ra muối ammonium:
- Sự hình thành ion ammonium ở các phản ứng trên là do sự tạo thành liên kết cho – nhận giữa nguyên tử nitrogen của phân tử ammonia với H+ (proton) của acid:
- Ammonia là một base theo thuyết Brosted – Lowry.
- Sự hình thành ion ammonium ở các phản ứng trên là do sự tạo thành liên kết cho – nhận giữa nguyên tử nitrogen của phân tử ammonia với H+ (proton) của acid.
- Ammonia là một base theo thuyết Brosted – Lowry.
Câu hỏi 1 (SGK tr.31):
Khi giấy quỳ tím ẩm tiếp xúc với khí ammonia thì hiện tượng gì sẽ xảy ra?
Khi giấy quỳ tím ẩm tiếp xúc với khí ammonia ® Chuyển sang màu xanh
- Tính khử
Nguyên tử N trong phân tử NH3 có số oxi hóa -3, là số oxi hóa thấp nhất của nguyên tố nitrogen trong các hợp chất.
Ammonia thể hiện tính khử khi phản ứng với một số chất có tính oxi hóa.
- Tổng hợp ammonia theo quá trình Haber
Thảo luận, trả lời câu hỏi:
- Vì sao đối với phản ứng tổng hợp ammonia theo quá trình Haber phải chọn điều kiện áp suất cao, trong khi đó không được chọn nhiệt độ quá cao và quá thấp?
- Vai trò của chất xúc tác trong phản ứng là gì?
- Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber. Phương trình hóa học của phản ứng diễn ra như sau:
- Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, cần chọn các điều kiện thích hợp về áp suất và nhiệt độ:
Về áp suất
Khi tăng áp suất
Cân bằng chuyển dịch theo chiều giảm áp suất của hệ (chiều tạo ammonia)
Về nhiệt độ
Cần giảm nhiệt độ
Cân bằng chuyển dịch theo chiều thuận, tạo ammonia
- Tổng hợp ammonia theo quá trình Haber
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 11 cánh diều
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 11 CÁNH DIỀU
GIÁO ÁN POWERPOINT LỚP 11 CÁNH DIỀU
GIÁO ÁN CHUYÊN ĐỀ LỚP 11 CÁNH DIỀU
Giáo án chuyên đề Công nghệ cơ khí 11 cánh diều đủ cả năm
Giáo án chuyên đề Tin học 11 Khoa học máy tính cánh diều đủ cả năm
Giáo án chuyên đề Tin học 11 Tin học ứng dụng cánh diều đủ cả năm
Giáo án chuyên đề Âm nhạc 11 cánh diều đủ cả năm
Giáo án chuyên đề Kinh tế pháp luật 11 cánh diều đủ cả năm
GIÁO ÁN DẠY THÊM LỚP 11 CÁNH DIỀU
Giáo án dạy thêm toán 11 cánh diều đủ cả năm
Giáo án dạy thêm ngữ văn 11 cánh diều đủ cả năm
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
