Trắc nghiệm câu trả lời ngắn Hoá học 11 kết nối Bài 4: Nitrogen
Tài liệu trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức Bài 4: Nitrogen. Dựa trên kiến thức của bài học, bộ tài liệu được biên soạn chi tiết, đúng trọng tâm và rõ ràng. Câu hỏi đa dạng với các mức độ khó dễ khác nhau. Tài liệu có file Word tải về. Thời gian tới, nội dung này sẽ tiếp tục được bổ sung.
Xem: => Giáo án hóa học 11 kết nối tri thức
Các tài liệu bổ trợ
BÀI 4. NITROGEN
Câu 1: Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị có khối lượng nguyên tử là
14
Câu 2: Cho các phản ứng:
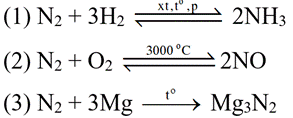
Có bao nhiêu phản ứng N2 thể hiện tính khử?
1
Câu 3: Cho các tính chất sau:
(1) Hóa lỏng ở nhiệt độ rất thấp (-196oC)
(2) Cấu tạo phân tử nitrogen là
(3) Tan nhiều trong nước
(4) Nặng hơn oxygen
(5) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử.
Các tính chất không thuộc về khí nitrogen là (Ghi thứ tự các phát biểu đúng từ nhỏ đến lớn, VD: 123, 234, 125…)
345
Câu 4: Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 7,437 lít N2 (đkc) là:
20,7
Câu 5: Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
| Liên kết | H – H | N – N | N≡N |
| Năng lượng liên kết (kJ.mol-1) | 436 | 389 | 946 |
và phản ứng: N2(g) + 3H2(g) → 2NH3(g). Khi có 1 mol NH3 tạo thành thì lượng nhiệt tỏa ra của phản ứng trên là bao nhiêu kJ?
40
Câu 6: Cho cân bằng (trong bình kín) sau: N2(g) + 3H2(g) ⇋ 2NH3(g)
Cho biết nồng độ các chất tại trạng thái cân bằng như sau:
[N2] = 0,45 M
[H2] = 0,14 M
[NH3] = 0,62 M
Giá trị hằng số cân bằng KC là: Kết quả làm tròn đến phần mười
311,3
BÀI TẬP THAM KHẢO THÊM
Câu 1: Trong tự nhiên, phản ứng giữa nitrogen và oxygen xảy ra trong những cơn mưa dông sấm sét, khởi đầu cho quá trình chuyển hóa từ nitrogen thành nitric acid. Nitric acid tan trong nước mưa và phân li ra ion nitrate (![]() ) là một dạng phân đạm mà cây trong hấp thụ được để sinh trưởng và phát triển. Quá trình chuyển hóa từ nitrogen thành nitric acid qua mấy giai đoạn?
) là một dạng phân đạm mà cây trong hấp thụ được để sinh trưởng và phát triển. Quá trình chuyển hóa từ nitrogen thành nitric acid qua mấy giai đoạn?
Trả lời: 4
Câu 2: Người ta sản xuất khí nitrogen trong công nghiệp bằng cách nào?
Trả lời: Chưng cất phân đoạn không khí lỏng.
Câu 3: Trong công nghiệp, người ta thường điều chế N2 từ gì?
Trả lời: Không khí
Câu 4: Cho phản ứng sau: ![]()
Trong phản ứng trên, nitrogen thể hiện tính chất gì?
Trả lời: Tính oxi hoá
Câu 5: Cho chuỗi sau : (A)![]() N2
N2 ![]() (B)
(B) ![]() (C)
(C) ![]() (D)
(D) ![]() HNO3
HNO3
Biết (A), (B), (C), (D) là các chất khác nhau. Chất (A) và (C) là
Trả lời: (A) là NH4NO2, (C) là NO
Câu 6: Trong Câu 6ca dao: “Lúa chiêm lấp ló đầu bờ
Nghe tiếng sấm giật phất cờ mà lên”
Cây lúa lớn nhanh nguyên nhân chính là do đâu?
Trả lời: ………………………………………
Câu 7: Cho phản ứng: ![]() Trong các yếu tố sau đây: (1) áp suất; (2) nhiệt độ; (3) nồng độ; (4) chất xúc tác, có mấy yếu tố ảnh hưởng đến cân bằng hóa học trên?
Trong các yếu tố sau đây: (1) áp suất; (2) nhiệt độ; (3) nồng độ; (4) chất xúc tác, có mấy yếu tố ảnh hưởng đến cân bằng hóa học trên?
Trả lời: ………………………………………
Câu 8: Cho phương trình hóa học của phản ứng tổng hợp amoniac:
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận thay đổi như thế nào?
Trả lời: ………………………………………
Câu 9: Trong phản ứng tổng hợp amoniac:
Để tăng hiệu suất phản ứng tổng hợp phải thay đổi những điều kiện nào?
Trả lời: ………………………………………
Câu 10: Cho 14,874 lít N2 (đkc) tác dụng với lượng dư khí H2. Biết hiệu suất của phản ứng là 30%, tính khối lượng NH3 tạo thành.
Trả lời: ………………………………………
Câu 11: Cho vào bình kín 0,2 mol N2 và 0,8 mol H2 với xúc tác thích hợp. Sau một thời gian thấy tạo ra 0,3 mol NH3. Tính hiệu suất phản ứng tổng hợp NH3
Trả lời: ………………………………………
Câu 12: Cho phản ứng: ![]()
Trong các yếu tố sau đây: (1) áp suất; (2) nhiệt độ; (3) nồng độ; (4) chất xúc tác, có mấy yếu tố ảnh hưởng đến cân bằng hóa học trên?
Trả lời: ………………………………………
Câu 13: Một bình kín dung tích không đổi chứa hỗn hợp N2 và H2 (có xúc tác thích hợp). Nung nóng bình một thời gian, sau đó đưa về nhiệt độ ban đầu, thấy áp suất trong bình giảm 18,4% so với áp suất ban đầu. Tỉ khối của hỗn hợp khí thu được sau phản ứng so với H2 bằng 6,164. Tính hiệu suất phản ứng tổng hợp NH3.
Trả lời: ………………………………………
Câu 14: Một hỗn hợp N2, H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau thời gian phản ứng, áp suất của các khí trong bình giảm 5% so với áp suất lúc đầu. Biết rằng phần trăm số mol của N2 đã phản ứng là 10%. Tính phần trăm thể tích của các khí N2 trong hỗn hợp đầu.
Trả lời: ………………………………………
Câu 15: Hỗn hợp X gồm N2 và H2 có tỉ khối đối với H2 bằng 3,6. Nung nóng X trong bình kín ở nhiệt độ khoảng 4500C có bột Fe xúc tác, thu được hỗn hợp khí Y có số mol giảm 8% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
Trả lời: ………………………………………
Câu 16: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Tính hiệu suất của phản ứng tổng hợp NH3
Trả lời: ………………………………………
Câu 17: Trong bình kín dung tích không đổi chứa hỗn hợp khí X gồm H2 và N2 (chất xúc tác thích hợp), áp suất trong bình là p atm, tỉ khối của X so với H2 là 5. Nung nóng bình để thực hiện phản ứng tổng hợp NH3, rồi làm nguội bình về nhiệt độ ban đầu, thu được hỗn hợp khí Y, áp suất trong bình là 0,88p atm. Tính hiệu suất phản ứng tổng hợp NH3.
Trả lời: ………………………………………
Câu 18: Cho phương trình hoá học:
Nếu ở trạng thái cân bằng nồng độ của NH3 là 0,30 mol/l, của N2 là 0,05 mol/l và của H2 là 0,10 mol/l. Tính hằng số cân bằng của hệ
Trả lời: ………………………………………
Câu 19: Nung một lượng NH3 trong bình kín. Sau một thời gian đưa về nhiệt độ ban đầu thấy áp suất khí trong bình tăng 1,5 lần so với áp suất ban đầu. Tính tỉ lệ NH3 bị phân hủy.
Trả lời: ………………………………………
Câu 20: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Trả lời: ………………………………………
Câu 21: Ở 472°C, hằng số cân bằng của phản ứng tổng hợp ammonia từ nitrogen và hydrogen theo quá trình Haber là KC = 0,105. Giả sử, kết quả phân tích cho thấy tại thời điểm cân bằng, nồng độ của nitrogen và hydrogen trong buồng phản ứng lần lượt là 0,0201 M và 0,0602 M. Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng.
Trả lời: ………………………………………
Câu 22: Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1: 3. Nung nóng X trong bình kín (450 °C, xúc tác Fe) một thời gian, thu được hỗn hợp khí có số mol giảm 5% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
Trả lời: ………………………………………
Câu 23: Cho sơ đồ chuyển hóa nitrogen trong khí quyển thành phân đạm: ![]() . Tính số phản ứng thuộc loại oxi hóa – khử trong sơ đồ.
. Tính số phản ứng thuộc loại oxi hóa – khử trong sơ đồ.
Trả lời: ………………………………………
Câu 24: Trong công nghiệp thực phẩm, nitrogen lỏng (D=0,808 g/ml) được phun vào vỏ bao bì trước khi đóng nắp để làm căng vỏ bao bì. Thể tích khí nitrogen thu được (đkc) khi hóa hơi 1 ml nitrogen lỏng là:
Trả lời: ………………………………………
Câu 25: Cho cân bằng hóa học sau: N2 (g) + 3H2 (g) ![]() 2NH3 (g) .
2NH3 (g) . ![]() < 0.
< 0.
Tổng số mol của hỗn hợp khí khi hệ đạt cân bằng ở nhiệt độ 400oC và 500oC là lượt là x và y. Mối quan hệ giữa x và y là:
Trả lời: ………………………………………
----------------------------------
----------------------- Còn tiếp -------------------------
