Giáo án điện tử Hoá học 11 kết nối Bài 3: Ôn tập chương 1
Bài giảng điện tử Hoá học 11 kết nối tri thức. Giáo án powerpoint Bài 3: Ôn tập chương 1. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt, tạo hứng thú học tập cho học sinh. Thầy, cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 11 kết nối tri thức
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét







Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 11 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC HÔM NAY!
KHỞI ĐỘNG
Hoàn thành phiếu học tập
- Cân bằng hóa học
......................................................... aA + bB cC + dD Phản ứng chỉ xảy ra ................... từ chất đầu tạo thành sản phẩm | Phản ứng thuận nghịch ......................................................... Trong cùng điều kiện, phản ứng xảy ra theo ................... trái ngược nhau |
Trạng thái cân bằng | vthuận = .............. ; nồng độ các chất trong hệ phản ứng .......................... |
Hằng số cân bằng | Kc = Trong đó: ..........................................................Chất rắn không đưa vào biểu thức tính KC KC chỉ phụ thuộc vào .......................... |
Các yếu tố ảnh hưởng đến cân bằng hóa học | ........................................................ |
Nguyên lí chuyển dịch cân bằng Le Chatelier | .............................................................. |
- Cân bằng trong dung dịch nước
- a) Sự điện li
Khái niệm: ..............................................................................................................
Chất điện li mạnh: ..................................................................................................
Chất điện li yếu: .....................................................................................................
Chất không điện li: .................................................................................................
- b) Thuyết acid – base của Bronsted – Lowry
Acid là.....................................................................................................................
Base là....................................................................................................................
- Cân bằng trong dung dịch nước
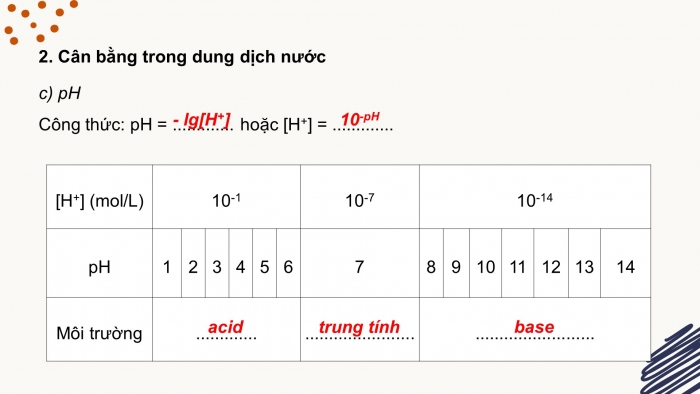
- c) pH
Công thức: pH = ............. hoặc [H+] = .............
[H+] (mol/L) | 10-1 | 10-7 | 10-14 | |||||||||||
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
Môi trường | ............. | ....................... | ......................... | |||||||||||
- d) Phản ứng thủy phân
Khái niệm: ..................................................................................................................................................................................................................................................................
Phương trình phản ứng của các ion Al3+, Fe3+ và
.................................................................................................................................
.................................................................................................................................
..................................................................................................................................................................................................................................................................
BÀI 3: ÔN TẬP CHƯƠNG I
LUYỆN TẬP
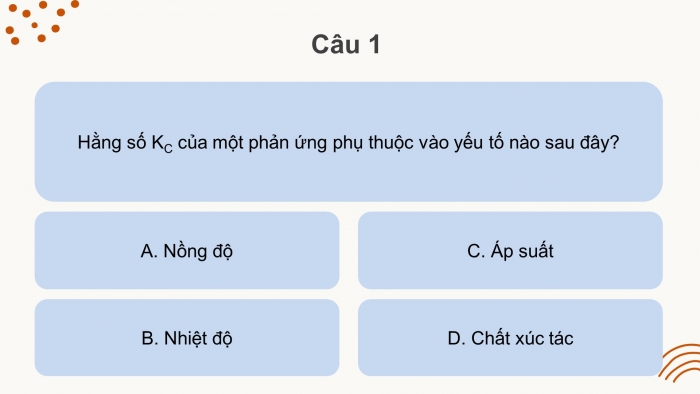
Câu 1
Hằng số KC của một phản ứng phụ thuộc vào yếu tố nào sau đây?
- Nồng độ
- Nhiệt độ
- Áp suất
- Chất xúc tác
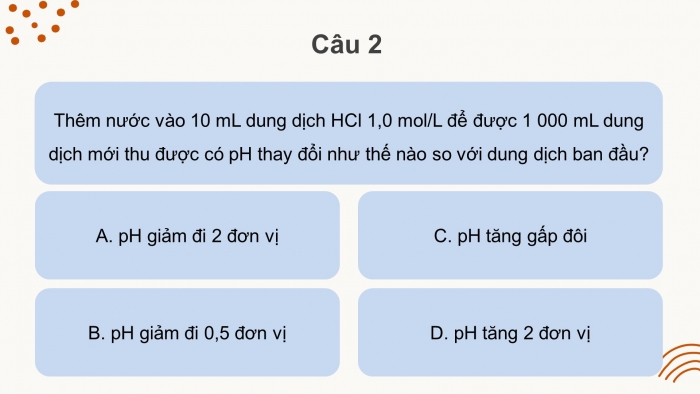
Câu 2
Thêm nước vào 10 mL dung dịch HCl 1,0 mol/L để được 1 000 mL dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
- pH giảm đi 2 đơn vị
- pH giảm đi 0,5 đơn vị
- pH tăng gấp đôi
- pH tăng 2 đơn vị
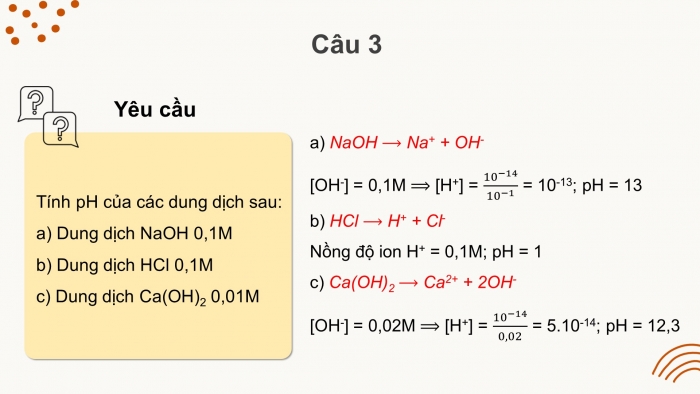
Câu 3
Yêu cầu
Tính pH của các dung dịch sau:
- a) Dung dịch NaOH 0,1M
- b) Dung dịch HCl 0,1M
- c) Dung dịch Ca(OH)2 0,01M
- a) NaOH Na+ + OH-
[OH-] = 0,1M [H+] = = 10-13; pH = 13
- b) HCl H+ + Cl-
Nồng độ ion H+ = 0,1M; pH = 1
- c) Ca(OH)2 Ca2+ + 2OH-
[OH-] = 0,02M [H+] = = 5.10-14; pH = 12,3
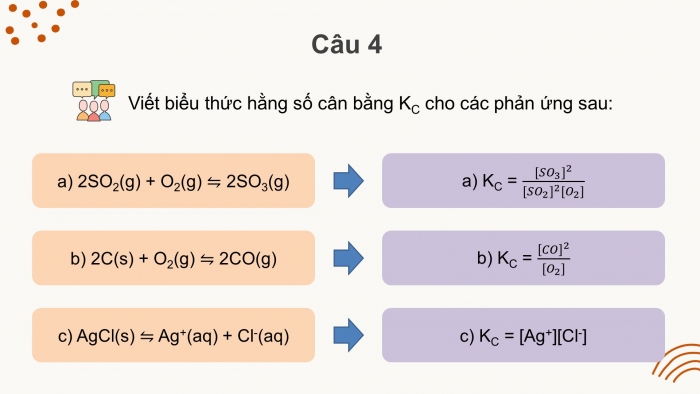
Câu 4
Viết biểu thức hằng số cân bằng KC cho các phản ứng sau:
- a) 2SO2(g) + O2(g) 2SO3(g)
> a) KC =
- b) 2C(s) + O2(g) 2CO(g)
> b) KC =
- c) AgCl(s) Ag+(aq) + Cl-(aq)
> c) KC = [Ag+][Cl-]
Câu 5
Cho cân bằng hóa học sau: H2(g) + I2(g) 2HI(g)
Nhận xét nào sau đây không đúng?
- Khi tăng nhiệt độ, cân bằng trên chuyển dịch theo chiều nghịch
- Ở nhiệt độ không đổi, khi tăng áp suất thì cân bằng không bị chuyển dịch
- Ở nhiệt độ không đổi, khi tăng nồng độ H2 hoặc I2 thì giá trị hằng số cân bằng tăng
- Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch
Câu 6
Xét phản ứng xảy ra trong lò luyện gang:
Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)
Nêu các yếu tố (nồng độ, nhiệt độ, áp suất) cần tác động vào cân bằng trên để cân bằng chuyển dịch về bên phải (làm tăng hiệu suất của phản ứng)?
Nồng độ: Tăng nồng độ của chất tham gia (tăng nồng độ của CO) hoặc giảm nồng độ của chất sản phẩm (giảm nồng độ của khí CO2)
Nhiệt độ: Cân bằng trên là tỏa nhiệt, vì vậy khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận
Áp suất: Số mol khí vế bên phải và bên trái bằng nhau, vì vậy khi tăng/giảm áp suất, cân bằng đều không dịch chuyển
Câu 7
Cho cân bằng hóa học sau: CO(g) + H2O(g) H2(g) + CO2(g)
Ở 427 oC, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín dung tích 10 lít và giữ ở 427oC. Tính nồng độ các chất ở trạng thái cân bằng.
CO(g) + H2O(g) H2(g) + CO2(g)
Ban đầu 1,0 mol 1,0 mol
Phản ứng x x x x
Cân bằng 1 – x 1 – x x x
KC = 8,3 x = 0,742
Nồng độ các chất ở trạng thái cân bằng:
[H2] = 0,0742 mol/L
[CO2] = 0,0742 mol/L
[CO] = 0,0258 mol/L
VẬN DỤNG
HÁI HOA DÂN CHỦ
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Hệ thống có đủ tài liệu:
- Giáo án điện tử hoá học 11 kết nối tri thức (340k)
- Giáo án hóa học 11 kết nối tri thức (295k)
- Giáo án chuyên đề hóa học 11 kết nối tri thức (295k)
- Giáo án powerpoint hóa học 11 kết nối tri thức (340k)
- Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức (150k)
- Giáo án hóa học 11 kết nối tri thức đủ cả năm (295k)
- Đề thi hóa học 11 kết nối tri thức (150k)
- File word đáp án hóa học 11 kết nối tri thức (100k)
- Bài tập file word Hóa học 11 kết nối tri thức (150k)
- Kiến thức trọng tâm hóa học 11 kết nối tri thức (150k)
- Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức (100k)
- Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức (150k)
- Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức (340k)
- Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm (150k)
- Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm (150k)
- Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm (150k)
=> Có thể chọn nâng cấp VIP với phí là 850k để tải tất cả tài liệu ở trên
- Chỉ gửi 550k. Tải về dùng thực tế, 1 ngày sau mới gửi số còn lại.
Cách tải hoặc nâng cấp:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 11 kết nối tri thức
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 11 KẾT NỐI TRI THỨC
GIÁO ÁN POWERPOINT LỚP 11 KẾT NỐI TRI THỨC
GIÁO ÁN CHUYÊN ĐỀ LỚP 11 KẾT NỐI TRI THỨC
GIÁO ÁN DẠY THÊM 11 KẾT NỐI TRI THỨC
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây

