Giáo án và PPT Hoá học 11 kết nối Bài 3: Ôn tập chương 1
Đồng bộ giáo án word và powerpoint (ppt) Bài 3: Ôn tập chương 1. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word







Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
BÀI 3: ÔN TẬP CHƯƠNG 1
HOẠT ĐỘNG KHỞI ĐỘNG – HỆ THỐNG HOÁ KIẾN THỨC
HỆ THỐNG KIẾN THỨC
1. Cân bằng hoá học
......................................... | Phản ứng thuận nghịch |
aA + bB → cC + dD Phản ứng chỉ xảy ra theo một chiều từ chất đầu tạo thành sản phẩm. | aA + bB ........... cC + dD Trong cùng một điều kiện, phản ứng xảy ra theo ............................... |
Trạng thái cân bằng | ............................................................................................ |
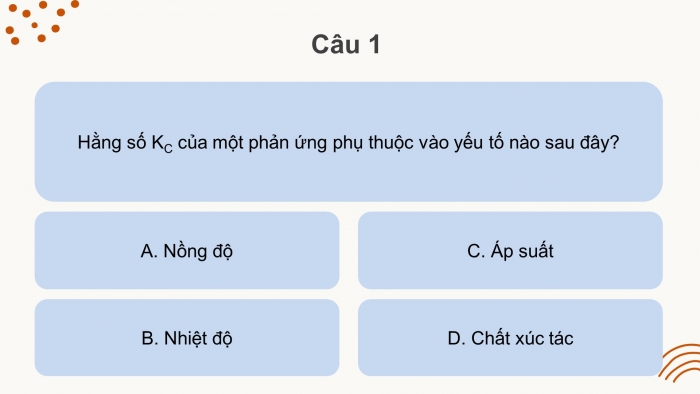
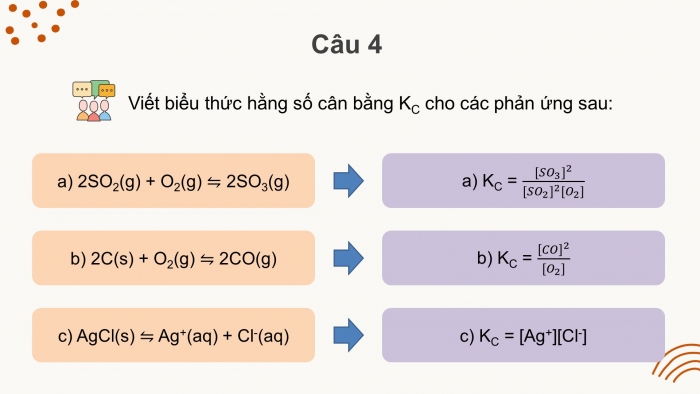
Hằng số cân bằng | Kc = ................................................................................... Chất rắn không đưa vào biểu thức tính KC. KC chỉ phụ thuộc vào ........................................................ |
Các yếu tố ảnh hưởng đến cân bằng hoá học | ........................................................................................... ........................................................................................... |
Nguyên lí chuyển dịch cân bằng Le Chatellier | ........................................................................................... ........................................................................................... |
2. Cân bằng trong dung dịch nước
Sự điện li Khái niệm: ............................................. Chất điện li mạnh gồm:......................... Chất điện li yếu gồm: ........................... Ví dụ 3 chất không điện li: .................. | Thuyết acid – base của Bronsted – Lowry Acid là: .............................. Base là: ............................. |
pH: ................................................................................................................................. | |
Phản ứng thuỷ phân là: .................................................................................................. Ví dụ: Al3+ + H2O ....................................................................................................... | |
Sản phẩm dự kiến:
HỆ THỐNG KIẾN THỨC
1. Cân bằng hoá học
Phản ứng một chiều | Phản ứng thuận nghịch |
aA + bB → cC + dD Phản ứng chỉ xảy ra theo một chiều từ chất đầu tạo thành sản phẩm. | aA + bB ⇄ cC + dD Trong cùng một điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau. |
Trạng thái cân bằng | vthuận = vnghịch; nồng độ các chất trong hệ phản ứng không đổi. |
Hằng số cân bằng |
Chất rắn không đưa vào biểu thức tính KC. KC chỉ phụ thuộc vào bản chất của phản ứng và nhiệt độ. |
Các yếu tố ảnh hưởng đến cân bằng hoá học | Nhiệt độ, nồng độ, áp suất |
Nguyên lí chuyển dịch cân bằng Le Chatellier | Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nhiệt độ, nồng độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó |
2. Cân bằng trong dung dịch nước
Sự điện li Khái niệm: Quá trình phân li các chất trong nước tạo thành ion Chất điện li mạnh gồm: acid mạnh, base mạnh, hầu hết muối Chất điện li yếu gồm: acid yếu, base yếu Ví dụ 3 chất không điện li: nước, saccharose, ethanol,... | Thuyết acid – base của Bronsted – Lowry Acid là: chất cho proton Base là: chất nhận proton | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
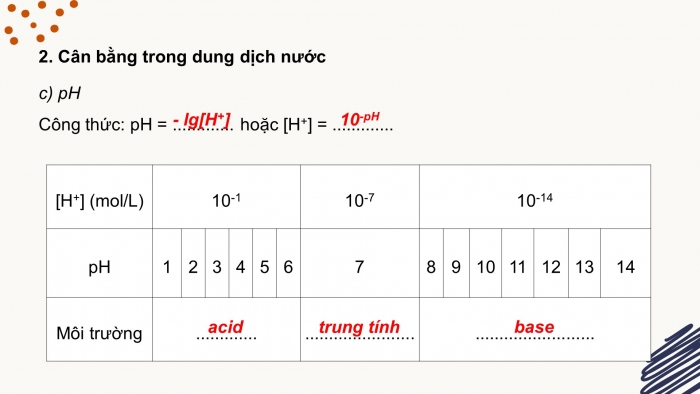
pH Công thức: pH = - lg[H+] hoặc [H+] = 10-pH
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Phản ứng thuỷ phân là: Phản ứng giữa ion với nước Ví dụ: Al3+ + 3H2O ⇌ Al(OH)3↓ + 3H+ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Trong dung dịch trung hòa về điện, tổng đại số điện tích của các ion bằng không. Dung dịch A có chứa 0,01 mol Mg2+; 0,01 mol Na+; 0,02 mol Cl- và x mol SO42. Giá trị của x là
A. 0,01.
B. 0,02.
C. 0,05.
D. 0,005.
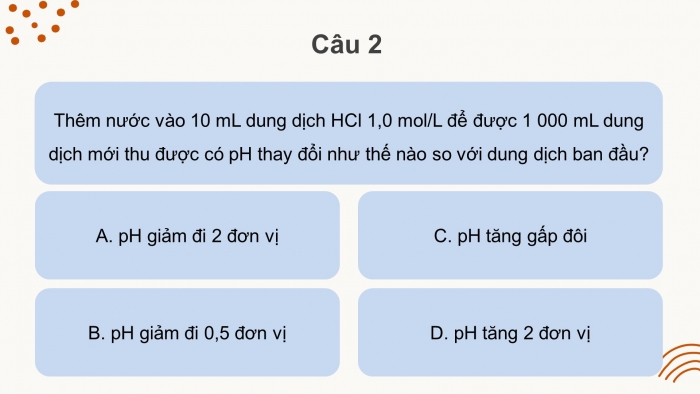
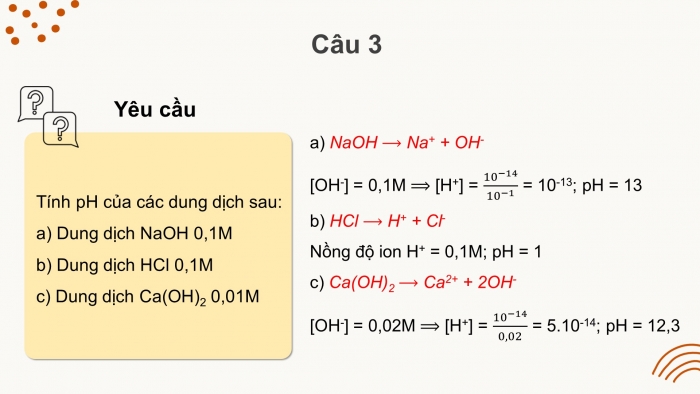
Câu 2: Giá trị pH của dung dịch NaOH 0,1 M là:
A. 1.
B. 13.
C. 11.
D. 3.
Câu 3: Cho a lít dung dịch KOH có pH = 12,0 vào 8,00 lít dung dịch HCl có pH = 3,0 thu được dung dịch Y có pH =11,0. Giá trị của a là
A. 1,60.
B. 0,80.
C. 1,78.
D. 0,12.
Sản phẩm dự kiến:
Câu 1: D
Câu 2: B
Câu 3: C
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Sự tăng áp suất ảnh hưởng như thế nào đến trạng thái cân bằng của các phản ứng hóa học sau:
a) 3O2(g) 2O3(g)
b) H2(k) + Br2(g) 2HBr(g)
c) N2O4(g) 2NO2(g)
Câu 2: Viết phương trình điện li của acid yếu CH3COOH trong dung dịch. Nếu hòa tan ít tinh thể chất điện li mạnh CH3COONa vào dung dịch acid trên thì nồng độ H+ tăng hay giảm? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm

