Giáo án và PPT Hoá học 11 kết nối Bài 8: Sulfuric acid và muối sulfate
Đồng bộ giáo án word và powerpoint (ppt) Bài 8: Sulfuric acid và muối sulfate. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word






Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
BÀI 8: SULFURIC ACID VÀ MUỐI SULFATE
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Hãy đoán xem đây là chất gì?
- Nó là một acid mạnh
- Nó có tính háo nước
- Nó có rất nhiều ứng dụng: Phẩm nhuộm, sơn, luyện kim, dầu khí, ắc quy, phân bón, dược phẩm
- Nó là thành phần chính của mưa acid
- Sử dụng nó không đúng cách sẽ gây nguy hiểm, bỏng nặng
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. SULFURIC ACID
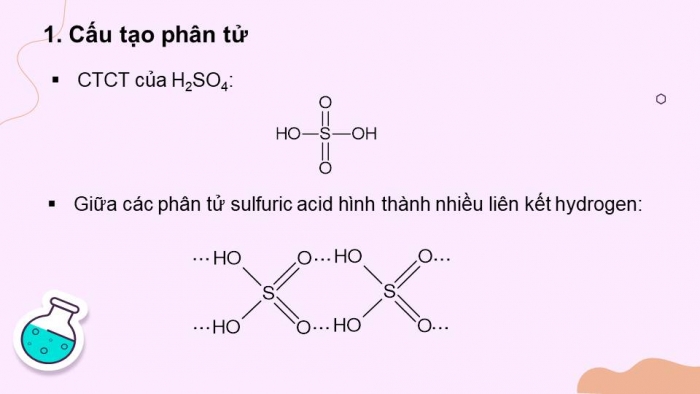
Hoạt động 1: Cấu tạo phân tử
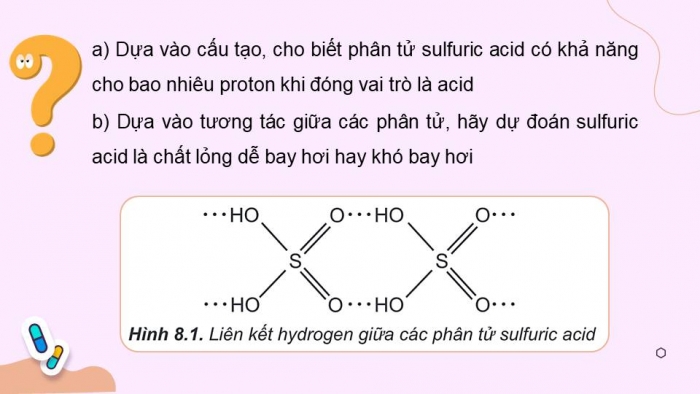
HS thảo luận trả lời câu hỏi:
Hãy viết công thức cấu tạo của phân tử sulfuric acid. Xác định loại liên kết.
Sản phẩm dự kiến:
- CTCT của H2SO4:

- Giữa các phân tử sulfuric acid hình thành nhiều liên kết hydrogen:

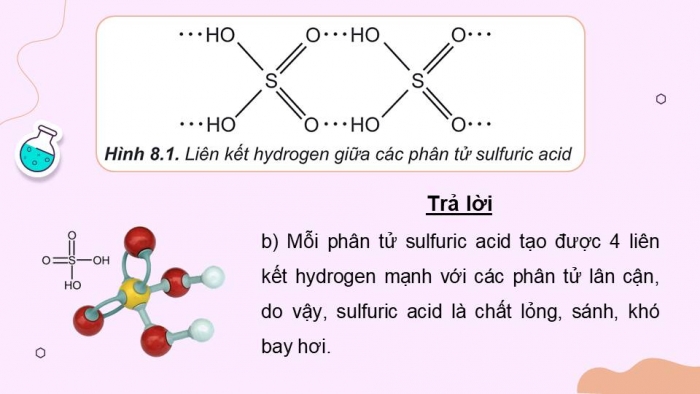
Hình 8.1. Liên kết hydrogen giữa các phân tử sulfuric acid
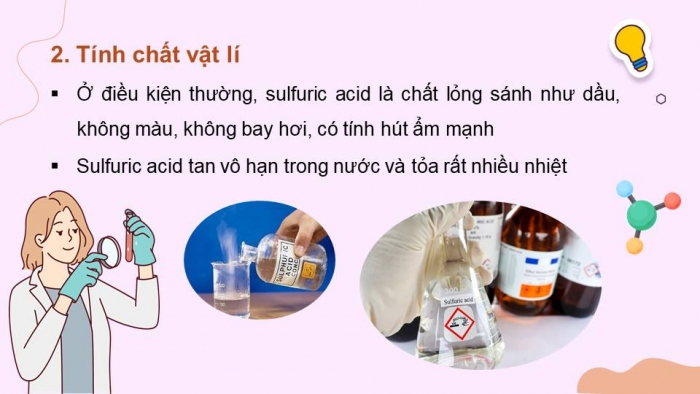
Hoạt động 2: Tính chất vật lí
HS thảo luận trả lời câu hỏi:
- Em hãy nêu tính chất vật lí của sulfuric acid.
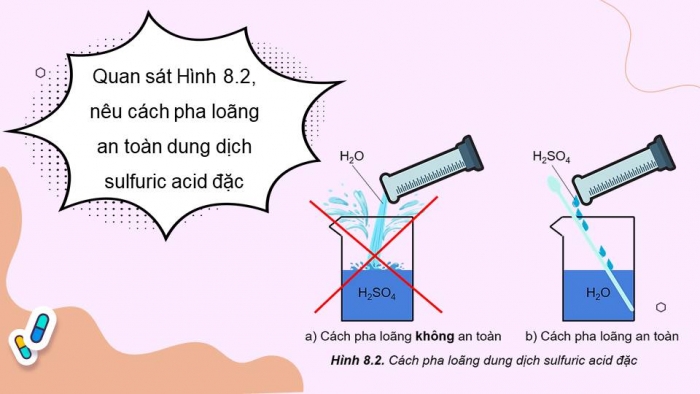
- Quan sát Hình 8.2, nêu cách pha loãng an toàn dung dịch sulfuric acid đặc
Sản phẩm dự kiến:
- Ở điều kiện thường, sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi, có tính hút ẩm mạnh
- Sulfuric acid tan vô hạn trong nước và tỏa rất nhiều nhiệt
- Khi pha loãng dung dịch sulfuric acid đặc, để đảm bảo an toàn phải rót từ từ dung dịch sulfuric acid đặc vào nước, vừa rót vừa khuấy (không làm ngược lại)

Hoạt động 3: Quy tắc an toàn
HS thảo luận trả lời câu hỏi:
- Em hãy nêu cách bảo quản sulfuric acid
- Nêu nguyên tắc bảo đảm an toàn khi sử dụng sulfuric acid.
- Nêu cách sơ cứu khi bị bỏng acid
Sản phẩm dự kiến:
Bảo quản: Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn, cách xa các lọ chứa dễ gây cháy nổ
Sử dụng: Khi sử dụng sulfuric acid cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng
(5) Không được đổ nước vào dung dịch acid đặc
Sơ cứu khi bỏng acid
(1) Nhanh chóng rửa ngay với nước lạnh nhiều lần:
+ Nếu bỏng ở vùng mặt thì nhắm chặt mắt khi ngâm rửa
+ Nếu acid bắn vào mắt thì úp mặt vào chậu nước sạch, mở mắt và chớp nhiều lần để rửa acid
(2) Tiến hành trung hòa acid bằng NaHCO3 loãng (2%)
(3) Băng bó tạm thời vết bỏng bằng băng sạch, uống bù nước điện giải rồi đến cơ sở y tế gần nhất
Hoạt động 4: Tính chất hóa học
HS thảo luận trả lời câu hỏi:
Em hãy tìm hiểu tính chất hoá học của sulfuric acid loãng và sulfuric acid đặc.
Sản phẩm dự kiến:
Dung dịch sulfuric acid loãng: Dung dịch sulfuric acid loãng có đầy đủ tính chất hóa học cơ bản của một acid: làm đổi màu giấy chỉ thị màu, tác dụng với base, basic oxide, kim loại và muối
Dung dịch sulfuric acid đặc
Tính acid
Tính oxi hóa
Tính háo nước
Hoạt động 5: Ứng dụng
HS thảo luận trả lời câu hỏi:
Em hãy nêu một số ứng dụng của sulfuric acid trong các ngành sản xuất và đời sống.
Sản phẩm dự kiến:
Sulfuric acid là hóa chất có tầm quan trọng bậc nhất vì hội tụ đầy đủ các yếu tố như: tính acid mạnh, tính oxi hóa mạnh, bền nhiệt, khó bay hơi, nguyên liệu sản xuất dồi dào, quy trình sản xuất có hiệu suất cao

Hoạt động 6: Sản xuất
HS thảo luận trả lời câu hỏi:
Nêu các giai đoạn sản xuất sulfuric acid, viết các PTHH minh họa tương ứng với mỗi giai đoạn (nếu có)
Sản phẩm dự kiến:
- Giai đoạn 1: Sản xuất sulfur dioxide
S(s) + O2(g)  SO2(g)
SO2(g)
4FeS2(s) + 11O2(g)  2Fe2O3(s) + 8SO2(g)
2Fe2O3(s) + 8SO2(g)
- Giai đoạn 2: Sản xuất sulfur trioxide

- Giai đoạn 3: Hấp thụ sulfur dioxide acid đặc, tạo ra oleum, sau đó pha loãng oleum vào nước được dung dịch sulfuric acid lõang cao (calcium sulfate)
II. MUỐI SULFATE
Hoạt động 1: Ứng dụng
HS thảo luận trả lời câu hỏi:
Em hãy nêu một số ứng dụng của muối sulfate.
Sản phẩm dự kiến:
- Sản xuất khoáng chất bổ sung cho phân bón, thức ăn gia súc (magnesium sulfate)
Công thức | Ứng dụng |
K2SO4 | Làm phân bón |
CuSO4.5H2O | Diệt trùng nước bể bơi, sản xuất thuốc Bordeaux diệt nấm |
KAl(SO4)2.12H2O | Phèn chua, dùng làm chất cầm màu, xử lí nước |
(NH4)2Fe(SO4)2.6H2O | Muối Mohr, dùng bảo quản iron(II) |
Hoạt động 2: Nhận biết
HS thảo luận trả lời câu hỏi:
Trả lời câu hỏi mục 2 SGK trang 53.
Sản phẩm dự kiến:
Thí nghiệm nhận biết ion ![]()
- Phương trình phân tử: BaCl2 + Na2SO4 ⟶ BaSO4 + 2NaCl
- Phương trình rút gọn: Ba2+ + ![]() ⟶ BaSO4
⟶ BaSO4
- Dự đoán hiện tượng: Xuất hiện kết tủa trắng barium sulfate theo phương trình hóa học: H2SO4 + BaCl2 ⟶ BaSO4 + 2HCl
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Dung dịch H2SO4 loãng phản ứng được với tất cả các kim loại thuộc dãy nào sau đây?
A. Cu, Na.
B. Ag, Zn.
C. Mg, Al.
D. Au, Pt.
Câu 2: Cho các chất: FeS, Cu2S, FeSO4, H2S, Ag, Fe, KMnO4, Na2SO3, Fe(OH)3. Số chất có thể phản ứng với H2SO4 đặc nóng tạo ra SO2 là
A. 9.
B. 8.
C. 6.
D. 7.
Câu 3: Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,2395 lít H2 (đkc) và dung dịch X. Khối lượng muối trong dung dịch X là
A. 4,83 gam.
B. 5,83 gam.
C. 7,33 gam.
D. 7,23 gam.
Sản phẩm dự kiến:
Câu 1: C
Câu 2: D
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Cho 2,81 gam hỗn hợp gồm 3 oxide Fe2O3, MgO, ZnO tan vừa đủ trong 300 ml dung dịch H2SO4 0,1M. Tính khối lượng muối sunfate khan tạo thành.
Câu 2: Nêu hiện tượng và viết PTHH (nếu có) khi cho lần lượt: mẩu quỳ tím, Zn, NaOH, Ba(OH)2 vào dung dịch sunfuric aicd.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
