Giáo án và PPT Hoá học 11 kết nối Bài 1: Khái niệm về cân bằng hoá học
Đồng bộ giáo án word và powerpoint (ppt) Bài 1: Khái niệm về cân bằng hoá học. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét










Giáo án ppt đồng bộ với word











Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
CHƯƠNG 1. CÂN BẰNG HÓA HỌC
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng thế này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
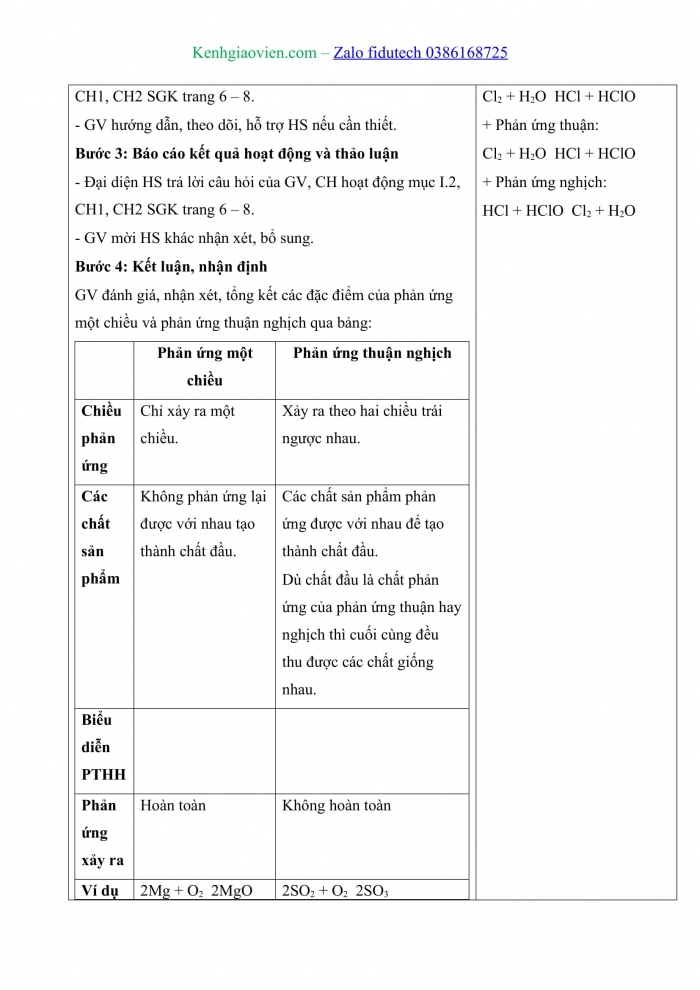
I. PHẢN ỨNG MỘT CHIỀU VÀ PHẢN ỨNG THUẬN NGHỊCH
Hoạt động 1: Phản ứng một chiều
HS thảo luận trả lời câu hỏi:
Phản ứng một chiều là gì?
Phản ứng một chiều được biểu diễn như thế nào?
Em hãy cho ví dụ về phản ứng một chiều.
Sản phẩm dự kiến:
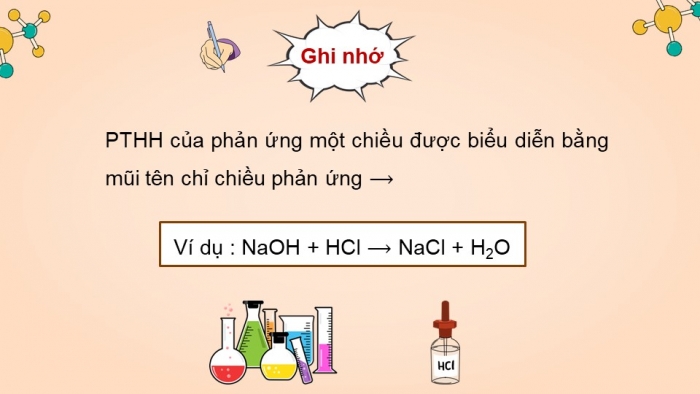
- Phản ứng một chiều là phản ứng chỉ xảy ra một chiều từ chất phản ứng tạo thành chất sản phẩm.
- Các chất sản phẩm không phản ứng lại được với nhau tạo thành chất đầu.
- PTHH của phản ứng một chiều được biểu diễn bằng mũi tên chỉ chiều phản ứng ⟶
Ví dụ : NaOH + HCl ⟶ NaCl + H2O
Hoạt động 2: Phản ứng thuận nghịch
HS thảo luận trả lời câu hỏi:
Viết phương trình hóa học của các phản ứng xảy ra trong thí nghiệm 1 và thí nghiệm 2.
Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng, Giải thích.
Phản ứng thuận nghịch là gì?
Phản ứng thuận nghịch được biểu diễn như thế nào?
Em hãy cho ví dụ về phản ứng thuận nghịch.
Sản phẩm dự kiến:
+ Thí nghiệm 1: H2(g) + I2(g) ⟶ 2HI(g)
+ Thí nghiệm 2: 2HI(g) ⟶ H2(g) + I2(g)
+ Ở thí nghiệm 1: khí H2 tác dụng với I2 tạo thành HI, đồng thời lại xảy ra phản ứng HI phân hủy tạo thành I2 và H2 nên dù thời gian phản ứng kéo dài bao lâu thì sau phản ứng các chất đầu H2, I2 vẫn còn.
+ Ở thí nghiệm 2 : khí HI phân hủy tạo thành H2 và I2, đồng thời lại xảy ra phản ứng khi H2 và I2 tạo thành HI nên dù thời gian phản ứng kéo dài bao lâu thì sau phản ứng chất đầu HI vẫn còn.
Kết luận:
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều
- PTHH của phản ứng hai chiều được biểu diễn bằng hai nửa mũi tên ngược chiều nhau ⇌. Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
Ví dụ: 3O2 ⇌ 2O3
II. CÂN BẰNG HÓA HỌC
Hoạt động 1: Trạng thái cân bằng
HS thảo luận trả lời câu hỏi:
Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian
Từ đồ thị, nhận xét sự thay đổi số mol của các chất theo thời gian.
Viết biểu thức định luật tác dụng khối lượng với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng thay đổi nữa?
Trạng thái cân bằng của phản ứng thuận nghịch là gì?
Em hãy nêu đặc điểm của cân bằng hoá học.
Sản phẩm dự kiến:
a)

b)
Theo thời gian, số mol H2 và I2 giảm dần và từ thời điểm t4, số mol của H2 và I2 không thay đổi nữa.
Theo thời gian, số mol HI tăng dần và từ thời điểm t4, số mol HI cũng không thay đổi nữa.
c)
Biểu thức định luật tác dụng khối lượng đối với phản ứng thuận:
vt = kt[H2].[I2]
Biểu thức định luật tác dụng khối lượng đối với phản ứng nghịch:
vn = kn[HI]2
Từ hai biểu thức cho thấy:
- Theo thời gian, số mol H2, I2 giảm dần nên [H2] và [I2] giảm, tốc độ phản ứng thuận giảm.
- Theo thời gian, số mol HI tăng dần nên [HI] tăng dần, tốc độ phản ứng nghịch tăng.
d) Từ thời điểm t4 thì số mol các chất trong hệ phản ứng không thay đổi.
- Khái niệm: Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Đặc điểm:
+ Cân bằng hóa học là một cân bằng động
+ Các chất tham gia phản ứng/sản phẩm liên tục phản ứng với nhau để tạo thành sản phẩm/chất đầu nhưng với tốc độ bằng nhau.
Ở trạng thái cân bằng, nồng độ các chất không đổi.
Hoạt động 2: Hằng số cân bằng
HS thảo luận trả lời câu hỏi:
Em hãy trình bày biểu thức của hằng số cân bằng của phản ứng thuận nghịch tổng quát.
Ở trạng thái cân bằng, hằng số cân bằng của phản ứng được xác định như thế nào?
Ý nghĩa của hằng số cân bằng là gì?
Em hãy trả lời câu hỏi mục 2 SGK trang 9.
Sản phẩm dự kiến:
* Biểu thức của hằng số cân bằng
- Xét phản ứng thuận nghịch tổng quát:
Aa + Bb ⇌ Cc + dD
- Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng được xác định theo biểu thức:
KC=[C]c[D]d[A]a[B]b
- Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng; a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
* Ý nghĩa của hằng số cân bằng
- KC phụ thuộc vào bản chất của phản ứng và nhiệt độ.
- KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại, KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế hơn.
* Câu hỏi mục 2 SGK trang 9:
Thí nghiệm 1: KC = 64,00; thí nghiệm 2: KC = 63, 99; thí nghiệm 3: KC = 64,08
Nhận xét: giá trị biểu thức KC = HI2H2[I2] thay đổi không đáng kể mặc dù nồng độ ban đầu và nồng độ các chất tại thời điểm cân bằng khác nhau.
a) KC=[NH3]2[H2]3[N2]
b) KC = [CO2]
III. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC.
Hoạt động 1: Ảnh hưởng của nhiệt độ
HS thảo luận trả lời câu hỏi:
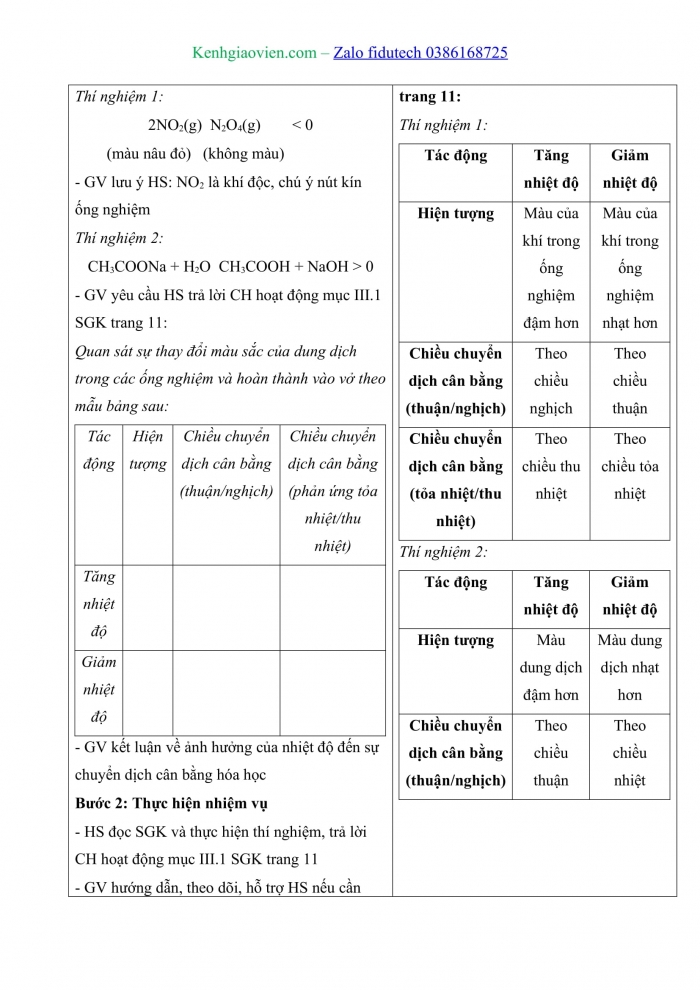
Trả lời câu hỏi hoạt động mục 1 SGK trang 11. Quan sát sự thay đổi màu sắc của dung dịch trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau:
Tác động | Tăng nhiệt độ | Giảm nhiệt độ |
Hiện tượng | ||
Chiều chuyển dịch cân bằng (thuận/nghịch) | ||
Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) |
Em hãy nêu ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng hoá học.
Sản phẩm dự kiến:
Thí nghiệm 1:
Tác động | Tăng nhiệt độ | Giảm nhiệt độ |
Hiện tượng | Màu của khí trong ống nghiệm đậm hơn | Màu của khí trong ống nghiệm nhạt hơn |
Chiều chuyển dịch cân bằng (thuận/nghịch) | Theo chiều nghịch | Theo chiều thuận |
Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) | Theo chiều thu nhiệt | Theo chiều tỏa nhiệt |
Thí nghiệm 2:
Tác động | Tăng nhiệt độ | Giảm nhiệt độ |
Hiện tượng | Màu dung dịch đậm hơn | Màu dung dịch nhạt hơn |
Chiều chuyển dịch cân bằng (thuận/nghịch) | Theo chiều thuận | Theo chiều nhiệt |
Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) | Theo chiều thu nhiệt | Theo chiều tỏa nhiệt |
=> Kết luận: Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt (∆rH298o > 0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại
Hoạt động 2: Ảnh hưởng của nồng độ
HS thảo luận trả lời câu hỏi:
Trả lời câu hỏi hoạt động mục 2 SGK trang 12: Quan sát sự thay đổi màu sắc của dung dịch trong các ống nghiệm (Hình 1.4) và hoàn thành vào vở theo mẫu bảng sau:
Tác động | Tăng nồng độ CH3COONa | Tăng nồng độ CH3COOH |
Hiện tượng | ||
Chiều chuyển dịch cân bằng (thuận/nghịch) | ||
Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) |
Em hãy nêu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng hoá học.
Sản phẩm dự kiến:
Tác động | Tăng nồng độ CH3COONa | Tăng nồng độ CH3COOH |
Hiện tượng | Màu dung dịch đậm hơn | Màu dung dịch nhạt hơn |
Chiều chuyển dịch cân bằng (thuận/nghịch) | Theo chiều thuận | Theo chiều nghịch |
Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) | Theo chiều làm giảm nồng độ CH3COONa | Theo chiều giảm nồng độ CH3COOH |
=> Kết luận: Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Cho cân bằng hóa học: 2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu nào sau đây đúng khi nói về cân bằng hóa học này?
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Câu 2: Thực hiện phản ứng tổng hợp amoniac N2 + 3H2 ⇆ 2NH3.
Nồng độ mol ban đầu của các chất như sau: [N2] = 1 mol/l; [H2] = 1,2 mol/l. Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/l. Hiệu suất của phản ứng là :
A. 43%.
B. 30%.
C. 25%.
D. 10%.
Câu 3: Cho cân bằng hóa học: CaCO3 (s) ⇄ CaO (s) + CO2 (g)
Biết phản ứng thuận là phản ứng thu nhiệt. Tác động nào sau đây vào hệ cân bằng để cân bằng đã cho chuyển dịch theo chiều thuận?
A. Tăng nồng độ khí CO2.
B. Tăng áp suất.
C. Giảm nhiệt độ.
D. Tăng nhiệt độ.
Sản phẩm dự kiến:
Câu 1: D
Câu 2: C
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Cho phương trình phản ứng:
N2(g) + O2(g) 2NO(g)
Ở 1 500K, hằng số cân bằng KC = 1,00.10-4. Giả sử một mẫu không khí có nồng độ N2 và O2 trước khi phản ứng lần lượt là 0,80 M và 0,20 M. Tính nồng độ ở thời điểm cân bằng của các chất phản ứng và sản phẩm sau khi hỗn hợp được đốt nóng ở 1 500K.
Câu 2: Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng nào dưới đây chuyển dịch theo chiều thuận? Giải thích
(1) CO(g) + H2O(g) H2(g) + CO2(g)
(2) PCl5(g) Cl2(g) + PCl3(g)
(3) H2(g) + I2(g) 2HI(g)
(4) 2SO2(g) + O2(g) 2SO3
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
