Giáo án và PPT Hoá học 11 kết nối Bài 5: Ammonia, Muối ammonium
Đồng bộ giáo án word và powerpoint (ppt) Bài 5: Ammonia, Muối ammonium. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word







Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
BÀI 5: AMMONIA – MUỐI AMMONIA
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Em hãy giải thích hiện tượng tính tan của ammonia trong nước.
I. AMMONIA
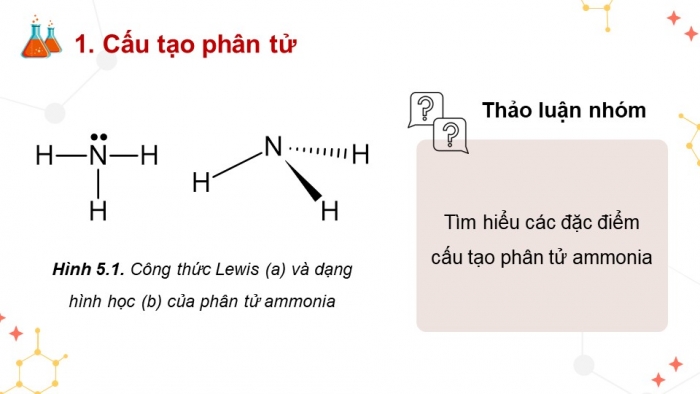
Hoạt động 1: Cấu tạo phân tử
HS thảo luận trả lời câu hỏi:
Em hãy trình bày đặc điểm cấu tạo của phân tử ammonia.
Sản phẩm dự kiến:
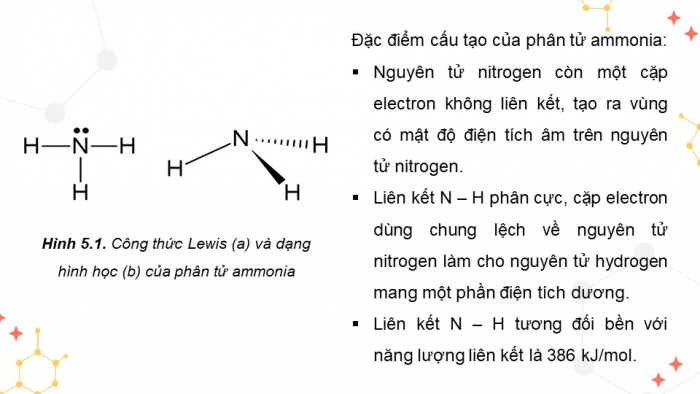
Đặc điểm cấu tạo của phân tử ammonia:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen
- Liên kết N – H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương
- Liên kết N – H tương đối bền với năng lượng liên kết là 386 kJ/mol
Hoạt động 2: Tính chất vật lí
HS thảo luận trả lời câu hỏi:
- Em hãy trình bày tính chất vật lí của ammonia.
- Trả lời CH2 SGK trang 34: Hãy giải thích tại sao ammonia tan tốt trong nước
Sản phẩm dự kiến:
Tính chất vật lí:
- Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc
- Ammonia tan nhiều trong nước
- Ammonia dễ hóa lỏng và dễ hóa rắn.
Trả lời CH2 SGK trang 34: Giữa các phân tử ammonia (chất tan) và phân tử nước (dung môi) có tương tác mạnh nên ammonia phân tán tốt vào nước, tức tan tốt trong nước. Hai tương tác cơ bản giữa các phân tử ammonia và nước là liên kết hydrogen và tương tác van der Waals (phân tử ammonia và nước đều phân cực mạnh)
Hoạt động 3: Tính chất hóa học
HS thảo luận trả lời câu hỏi:
- Em hãy trình bày tính base của ammonia.
- Trả lời CH hoạt động mục I.3 SGK trang 34
- Viết PTHH khi đốt cháy ammonia trong oxygen và khi cho ammonia tác dụng với oxygen ở nhiệt độ 800-900oC với xúc tác Pt.
Sản phẩm dự kiến:
Tính base

Dung dịch ammonia có môi trường base yếu, làm quỳ tím chuyển màu xanh, phenolphthalein chuyển màu hồng
Trả lời CH hoạt động mục I.3 SGK trang 34:
Trong các phản ứng trên, NH3 nhận proton (H+) nên thể hiện là base; HCl, HNO3 và H2SO4 nhường proton nên thể hiện là acid



Tính khử
4NH3 + 3O2 2N2 + 6H2O
2N2 + 6H2O
4NH3 + 5O2 4NO + 6H2O
4NO + 6H2O
Hoạt động 4: Ứng dụng
HS thảo luận trả lời câu hỏi:
Em hãy nêu một số ứng dụng của ammonia.
Sản phẩm dự kiến:
Một số ứng dụng của ammonia:
- Tác nhân làm lạnh
- Sản xuất nitric acid
- Dung môi
- Sản xuất phân đạm
- Ammonia có ứng dụng rộng rãi trong công nghiệp, nông nghiệp, y học và đời sống.
- Phần lớn ammonia được sử dụng làm phân bón như urea, đạm ammonium, ammophos
- Ammonia có nhiệt bay hơi lớn nên được dùng làm chất làm lạnh trong nhiều hệ thống làm công nghiệp, hệ thống điều hòa không khí tổng
- Ammonia là nguyên liệu trong sản xuất nitric acid theo phương pháp Ostwald, sản xuất soda theo phương pháp Solvey
- Ammonia lỏng là dung môi ion hóa được sử dụng khá phổ biến. Các kim loại kiềm tan vào ammonia lỏng tạo dung dịch màu xanh lam có chứa ion kim loại và electron
Ví dụ: Na(s) ⟶ Na+(aq) + e-(aq)
- Ngoài ra, ammonia được dùng trong xử lí môi trường, chất tẩy rửa bề mặt, kiểm soát pH của nước, trung hòa acid để bảo vệ thiết bị khỏi ăn mòn
Hoạt động 5: Sản xuất
HS thảo luận trả lời câu hỏi:
Trả lời câu hỏi mục 5 SGK trang 35.
Sản phẩm dự kiến:

1. Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (là chiều thu nhiệt, chiều nghịch), tăng nhiệt độ sẽ làm tăng tốc độ phản ứng nghịch
Ngược lại, nếu giảm nhiệt độ, cân bằng chuyển dịch theo chiều tỏa nhiệt (là chiều thuận) giảm nhiệt độ sẽ làm tăng tốc độ phản ứng thuận
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng áp suất (là chiều tăng số mol khí, chiều nghịch)
Ở áp suất càng cao thì yêu cầu về chất lượng thiết bị, an toàn lao động càng cao ⟹ tăng chi phí chế tạo, lắp đặt, vận hành, bảo dưỡng thiết bị
3. Chất xúc tác làm tăng cả tốc độ phản ứng thuận và phản ứng nghịch, làm hệ nhanh đạt đến trạng thái cân bằng
II. MUỐI AMMONIA
Hoạt động 1: Tính tan, sự điện li
HS thảo luận trả lời câu hỏi: N
Em hãy cho biết tính tan, sự điện li của muối ammonia. Lấy ví dụ.
Sản phẩm dự kiến:
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion
Ví dụ: NH4Cl ⟶ NH4+ + Cl-
Hoạt động 2: Tác dụng với kiềm – Nhận biết ion ammonium
HS thảo luận trả lời câu hỏi:
- Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm có hiện tượng gì?
- Lấy ví dụ và viết phương trình ion rút gọn.
Sản phẩm dự kiến:
Đun nóng hỗn hợp muối ammonium với dung dịch kiềm sinh ra khí có mùi khai
Ví dụ:
(NH4)2SO4 + 2NaOH  Na2SO4 + 2NH3 + 2H2O
Na2SO4 + 2NH3 + 2H2O
Phương trình ion rút gọn:

Hoạt động 3: Tính chất kém bền nhiệt
HS thảo luận trả lời câu hỏi:
Em hãy viết các PTHH cho thấy muối ammonium kém bền nhiệt và dễ bị phân huỷ khi nung nóng.
Sản phẩm dự kiến:
Các muối ammonium đều kém bền nhiệt và dễ bị phân hủy khi nung nóng
Ví dụ:
NH4Cl  NH3 + HCl
NH3 + HCl
NH4HCO3 NH3 + CO2 + H2O
NH3 + CO2 + H2O
NH4NO3 N2O + 2H2O
N2O + 2H2O
Hoạt động 4: Ứng dụng
HS thảo luận trả lời câu hỏi:
Em hãy nêu một số ứng dụng của muối ammonium.
Sản phẩm dự kiến:
Một số ứng dụng của muối ammonium:
+ Chất đánh sạch bề mặt kim loại
+ Thuốc long đờm
+ Phân bón hóa học
+ Chất phụ gia thực phẩm
+ Thuốc bổ sung chất điện giải
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Có ba dung dịch mất nhãn: NaCl; NH4Cl; NaNO3. Dãy hoá chất nào sau đây có thể phân biệt được ba dung dịch:
A. Phenolphthalein và NaOH.
B. Cu và HCl.
C. Phenolphthalein; Cu và H2SO4 loãng
D. Quỳ tím và dung dịch AgNO3.
Câu 2: Phản ứng giữa NH3 với chất nào sau đây chứng minh NH3 thể hiện tính base:
A. Cl2.
B. O2.
C. HCl.
D. CuO.
Câu 3: Cho 4 lít N2 và 14 lít H2 vào bình phản ứng ở điều kiện thích hợp, hỗn hợp thu được sau phản ứng có thể tích bằng 16,4 lít (thể tích các khí được đo ở cùng điều kiện). Hiệu suất phản ứng là
A. 30%.
B. 20%.
C. 17,14%.
D. 34,28%.
Sản phẩm dự kiến:
Câu 1: D
Câu 2: C
Câu 3: B
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Trình bày phương pháp hóa học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hóa học của các phản ứng đã dùng
Câu 2: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khí có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Tính hiệu suất của phản ứng
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
