Giáo án và PPT Hoá học 11 kết nối Bài 9: Ôn tập chương 2
Đồng bộ giáo án word và powerpoint (ppt) Bài 9: Ôn tập chương 2. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word











Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
BÀI 9: ÔN TẬP CHƯƠNG 2
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Xây dựng sơ đồ tư duy hệ thống hoá kiến thức chương 2
II. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
HS thảo luận trả lời câu hỏi:
Hoàn thành phiếu học tập dưới đây:
1. Nitrogen
- Nitrogen là nguyên tố phổ biến, góp phần tạo nên sự sống trên Trái Đất
- Cấu hình electron lớp ngoài cùng của nguyên tử: .......................
- Số oxi hóa thường gặp: .................................................................
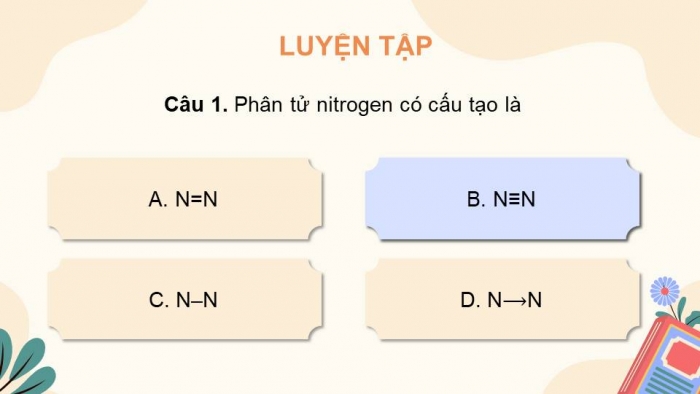
- Phân tử nitrogen gồm 2 nguyên tử liên kết với nhau bằng liên kết ...... bền vững (NN)
- Đơn chất nitrogen khá ............ ở nhiệt độ thường, hoạt động hóa học mạnh hơn khi đun nóng hoặc có xúc tác
- Đơn chất nitrogen thể hiện tính ....................... và tính .......................
2. Sulfur – Sulfur dioxide
a) Sulfur
- Sulfur là nguyên tố phổ biến trên Trái Đất, tồn tại ở cả dạng ......................... và .........................
- Cấu hình electron lớp ngoài cùng: .......................
- Số oxi hóa thường gặp: .................................................................
- Phân tử dạng mạch vòng gồm ....... nguyên tử (S8) và tương đối bền
- Sulfur thể hiện cả tính ....................... và tính .......................
b) Sulfur dioxide
- Sulfur dioxide phát thải ra môi trường từ quá trình .....................................................................................................................................
- Sulfur dioxide có tính chất của ......................, có tính ....................... và tính .......................
3. Ammonia – muối Ammonia
a) Ammonia
- Phân tử ammonia có dạng ..........................., phân tử còn .......... cặp electron không liên kết
- Khí ammonia có mùi ............., ............. tan trong nước, ............. hóa lỏng; ammonia có tính ............. và tính .............
- Ammonia được sản xuất từ .................. và .................. theo quá trình Haber – Bosch
b) Muối ammonium
- Muối ammonium thường ............. tan trong nước và ............. bền nhiệt
- Ion ammonium được nhận biết bằng phản ứng với ............., sinh ra khí có .................
4. Sulfuric acid – Muối sulfate
a) Sulfuric acid
- Dung dịch sulfuric acid loãng có đầy đủ tính chất của một .....................
- Dung dịch sulfuric acid đặc có tính ............. nước, có khả năng gây bỏng, có tính ..................... và tính ..............................
- Bảo quản, sử dụng sulfuric acid đặc phải tuân theo quy tắc đảm bảo an toàn, phòng chống cháy, nổ
- Sulfuric acid được sản xuất từ các nguyên liệu chính: ...............................................
b) Muối sulfate
- Các muối sulfate có nhiều ứng dụng thực tiễn: ammonium sulfate, ............................, ............................, ............................, ...
- Ion sulfate trong dung dịch được nhận biết bằng ion ..............
5. Một số hợp chất với oxygen của nitrogen
a) Oxide của nitrogen
- Các oxide của nitrogen là một trong số các tác nhân chính gây ô nhiễm ...................... và gây ......................
b) Nitric acid
- Nitric acid là chất ............., ....................... trong nước, ...................... trong không khí ẩm
- Nitric acid có tính ..................... và tính ..............................
Sản phẩm dự kiến:
1. Nitrogen
- Nitrogen là nguyên tố phổ biến, góp phần tạo nên sự sống trên Trái Đất.
- Cấu hình e lớp ngoài cùng của nguyên tử: 2s22p3
- Số oxi hoá thường gặp: -3, 0, +1, +2, +3, +4, +5.
- Phân tử nitrogen gồm hai nguyên tử liên kết với nhau bằng liên kết ba bền vững
- Đơn chất nitrogen khá trơ ở nhiệt độ thường, hoạt động hoá học mạnh hơn khi đun nóng và có xúc tác.
- Đơn chất nitrogen thể hiện cả tính oxi hoá và tính khử.
2. Sulfur – Sulfur Dioxide
a) Sulfur
- Sulfur là nguyên tố phổ biến trên Trái Đất, tồn tại ở cả dạng đơn chất và hợp chất.
- Cấu hình e lớp ngoài cùng của nguyên tử: 3s23p4
- Số oxi hoá thường gặp: -2, 0, +4, +6.
- Phân tử dạng mạch vòng gồm 8 nguyên tử liên kết với nhau (S8) và tương đối bền.
- Đơn chất sulfur thể hiện cả tính oxi hoá và tính khử.
b) Sulfur dioxide
- Sulfur dioxide phát thải ra môi trường từ quá trình đốt cháy nhiên liệu (than đá, dầu mỏ), đốt cháy sulfur và khoáng vật sulfide
- Sulfur dioxide có tính chất của oxide, có tính oxi hoá và tính khử.
3. Ammonia – Muối ammoium
a) Ammonia
- Phân tử ammonia có dạng chóp tam giác, phân tử còn một cặp electron không liên kết.
- Khí ammonia có mùi khai, dễ tan trong nước, dễ hoá lỏng; ammonia có tính base và tính khử.
- Ammonia được sản xuất từ nitrogen và hydrogen theo quá trình Haber-Bosch.
b) Muối ammonium
- Muối ammonium thường dễ tan trong nước và kém bền nhiệt.
- Ion ammonium được nhận biết bằng phản ứng với kiềm, sinh ra khí có mùi khai.
4. Sufluric acid – Muối sulfate
a) Sufluric acid
- Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh.
- Dung dịch sulfur acid đặc có tính háo nước, có khả năng gây bỏng, có tính acid mạnh và tính oxi hoá mạnh.
- Bảo quản, sử dụng sulfur acid đặc phải tuân theo quy tắc đảm bảo an toàn, phòng chống cháy, nổ.
- Sulfur acid được sản xuất từ các nguyên liệu chính: sulfur, quặng pyrite.
b) Muối sulfate
- Các muối sulfate có nhiều ứng dụng thực tiễn: ammonium sulfate, barium sulfate, calcium sulfate, magnesium sulfate,…
- Ion sulfate trong dung dịch được nhận biết bằng ion Ba2+.
5. Một số hợp chất với oxygen của nitrogen
a) Oxide của nitrogen
- Các oxide của nitrogen là một trong số các tác nhân chính gây ô nhiễm môi trường không khí và gây mưa acid.
b) Nitric acid
- Nitric acid là chất lỏng, tan tốt trong nước, bốc khói trong không khí ẩm
- Nitric acid có tínhacid mạnh và tínhoxi hoá mạnh.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Trong phản ứng tổng hợp ammonia:

Để tăng hiệu suất phản ứng tổng hợp phải
A. giảm nhiệt độ và áp suất.
B. tăng nhiệt độ và áp suất.
C. tăng nhiệt độ và giảm áp suất.
D. giảm nhiệt độ vừa phải và tăng áp suất.
Câu 2: Cho 9,916 lít N2 (đkc) tác dụng với 22,311 lít H2 (đkc), thu được 3,4 gam NH3. Hiệu suất của phản ứng là
A. 20%.
B. 34%.
C. 33,3%.
D. 50%.
Câu 3: Ammonia đóng vai trò chất khử khi tác dụng với chất nào sau đây?
A. H2O.
B. HCl.
C. H3PO4.
D. O2 (Pt, to)
Sản phẩm dự kiến:
Câu 1: D
Câu 2: C
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Cho 1,32 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Xác định muối thu được
Câu 2: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Tính thể tích dung dịch HNO3 đã dùng.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
