Giáo án và PPT Hoá học 11 kết nối Bài 2: Cân bằng trong dung dịch nước
Đồng bộ giáo án word và powerpoint (ppt) Bài 2: Cân bằng trong dung dịch nước. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét











Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
BÀI 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. SỰ ĐIỆN LI
Hoạt động 1: Hiện tượng điện li
HS thảo luận trả lời câu hỏi:
Dòng điện là gì?
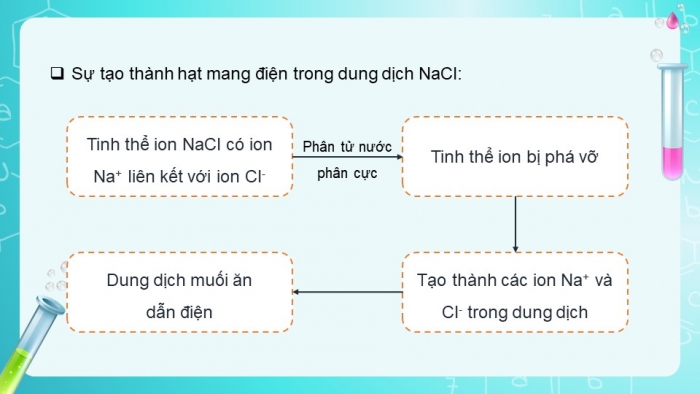
Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ trong dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion)?
Hãy giải thích sự tạo thành hạt mang điện đó?
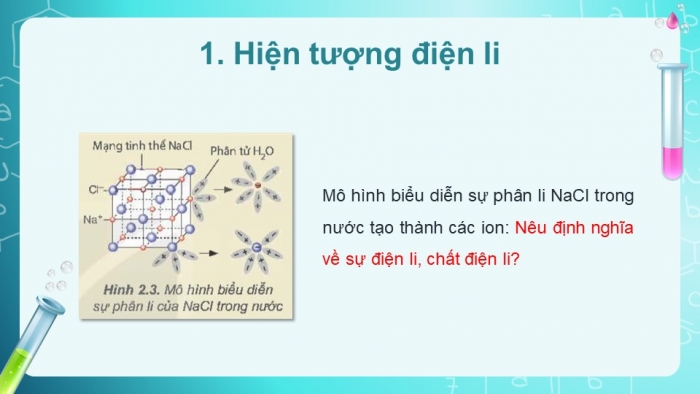
Em hãy nêu khái niệm về sự điện li, chất điện li.
Sản phẩm dự kiến:
- Dòng điện là dòng chuyển dời có hướng của các hạt mang điện
- Trong dung dịch muối ăn có ion âm (anion và ion dương (cation)
- NaCl là tinh thể ion, trong tinh thể có ion Na+ liên kết với ion Cl-, dưới tác dụng của phân tử nước phân cực, tinh thể ion bị phá vỡ và tạo thành các ion Na+ và Cl- trong dung dịch, vì vậy dung dịch muối ăn dẫn điện
=> Kết luận: Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra các ion được gọi là chất điện li
Hoạt động 2: Chất điện li
HS thảo luận trả lời câu hỏi:
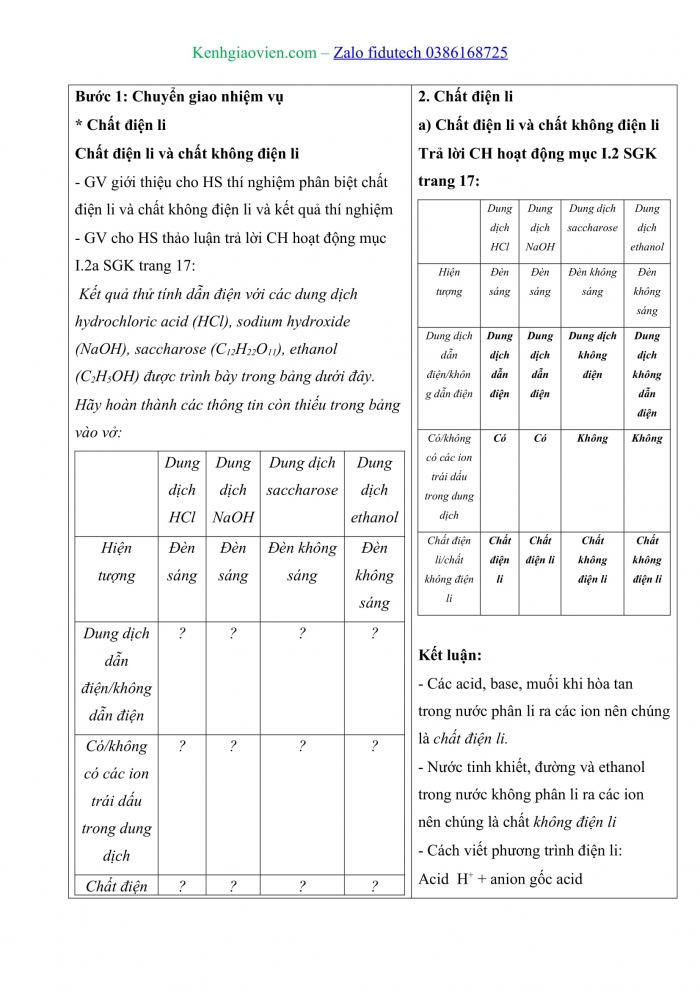
Trả lời câu hỏi hoạt động mục 2 trang 17: Kết quả thử tính dẫn điện với các dung dịch hydrochloric acid (HCl), sodium hydroxide (NaOH), saccharose (C12H22O11), ethanol (C2H5OH) được trình bày trong bảng dưới đây.
Dung dịch HCl | Dung dịch NaOH | Dung dịch saccharose | Dung dịch ethanol | |
Hiện tượng | Đèn sáng | Đèn sáng | Đèn không sáng | Đèn không sáng |
Dung dịch dẫn điện/không dẫn điện | ||||
Có/không có các ion trái dấu trong dung dịch | ||||
Chất điện li/chất không điện li |
Chất điện li là gì? Chất không điện li là gì?
Em hãy trình bày cách viết phương trình điện li.
Thế nào là chất điện li mạnh? Em hãy liệt kê một số chất điện li mạnh thường gặp.
Quá trình phân li của chất điện li mạnh được biểu diễn như thế nào?
Chất điện li yếu là gì? Em hãy liệt kê một số chất điên li yếu.
Quá trình phân li của chất điện li yếu được biểu diễn như thế nào?
Viết PTHH dạng phân tử và dạng ion rút gọn của phản ứng xảy ra giữa: Dung dịch Na2CO3 và dung dịch HCl.
Sản phẩm dự kiến:
a) Chất điện li và chất không điện li
Dung dịch HCl | Dung dịch NaOH | Dung dịch saccharose | Dung dịch ethanol | |
Hiện tượng | Đèn sáng | Đèn sáng | Đèn không sáng | Đèn không sáng |
Dung dịch dẫn điện/không dẫn điện | Dung dịch dẫn điện | Dung dịch dẫn điện | Dung dịch không điện | Dung dịch không dẫn điện |
Có/không có các ion trái dấu trong dung dịch | Có | Có | Không | Không |
Chất điện li/chất không điện li | Chất điện li | Chất điện li | Chất không điện li | Chất không điện li |
=> Kết luận:
- Các acid, base, muối khi hòa tan trong nước phân li ra các ion nên chúng là chất điện li.
- Nước tinh khiết, đường và ethanol trong nước không phân li ra các ion nên chúng là chất không điện li
- Cách viết phương trình điện li:
Acid ⟶ H+ + anion gốc acid
Base ⟶ cation kim loại/NH4+ + OH-
Muối ⟶ cation kim loại/NH4+ + anion gốc acid
Ví dụ: Na2CO3 ⟶ 2Na+ + CO32-
H2SO4⟶ 2H+ + SO42-
Ba(OH)2⟶ Ba2+ + 2OH-
- Dựa vào mức độ phân li thành các ion, chất điện li được chia thành hai loại:
Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion.
Các chất điện li mạnh thường gặp:
Acid mạnh: HCl, HNO3, H2SO4,...
Base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2,...
Hầu hết các muối
- Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng mũi tên một chiều.

- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch
- Những chất điện li yếu gồm các acid yếu như CH3COOH, HClO, HF, H2CO3,... và các base yếu như Cu(OH)2, Fe(OH)2,...
- Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau:
CH3COOH ⇌ H+ + CH3COO-
Phương trình phản ứng dạng phân tử và dạng ion rút gọn của phản ứng xảy ra giữa dung dịch Na2CO3 và dung dịch HCl:
- Phương trình phân tử:
Na2CO3 + 2HCl ⟶ 2NaCl + CO2 + H2O

II. THUYẾT AXID – BASE CỦA BR∅NSTED - LOWRY
Hoạt động 1: Khái niệm acid và base theo thuyết Bronsted - Lowry
HS thảo luận trả lời câu hỏi:
Cho các dung dịch: HCl, NaOH, Na2CO3. Viết phương trình điện li của các chất trên
Sử dụng máy đo pH (hoặc giấy pH) xác định pH, môi trường (acid/base) của các dung dịch trên.
Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, trong những chất cho ở trên: Chất nào là acid ? Chất nào là base?
Em hãy cho biết hạn chế về định nghĩa acid – base của thuyết Arrhenius (đã học ở lớp 8).
Em hãy nêu định nghĩa acid – base của Bronsted – Lowry
Sản phẩm dự kiến:
a) Phương trình điện li:
HCl ⟶ H+ + Cl-
NaOH ⟶ Na+ + OH-
![]()
b) Dung dịch HCl có môi trường acid (pH < 7), còn dung dịch NaOH và Na2CO3 có môi trường base (pH > 7)
c) Theo định nghĩa acid – base đã học ở môn Khoa học tự nhiên lớp 8, HCl là acid, NaOH là base, còn Na2CO3 không là base
*Kết luận:
- Khái niệm acid – base đề cập ở lớp 8 chỉ đúng với dung môi nước và chưa phản ánh đầy đủ bản chất acid/base.
- Thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton
Hoạt động 2: Ưu điểm của thuyết Bronsted – Lowry
HS thảo luận trả lời câu hỏi:
Em hãy nêu các ưu điểm của thuyết Bronsted – Lowry.
Sản phẩm dự kiến:

III. KHÁI NIỆM PH VÀ Ý NGHĨA
Hoạt động 1: Khái niệm pH
HS thảo luận trả lời câu hỏi:
Em hãy cho biết quy ước của đại lượng pH.
Trả lời câu hỏi 5 SGK trang 21. pH của dung dịch nào sau đây có giá trị nhỏ nhất ?
A. Dung dịch HCl 0,1M
B. Dung dịch CH3COOH 0,1M
C. Dung dịch NaCl 0,1M
D. Dung dịch NaOH 0,01M
Sản phẩm dự kiến:
- Quy ước:
pH = - lg[H+] hoặc [H+] = 10-pH
Trong đó [H+] là nồng độ mol của ion H+
Nếu dung dịch có [H+] = 10-a mol/L thì pH = a
- Câu hỏi 5 SGK trang 21:
CH3COOH là chất điện li yếu ⟹ [H+] < 0,1M ⟹ pHCH3COOH > 1
pHHCl = 1 ; pHNaCl = 7 ; pHNaOH = 12
Vậy pH của dung dịch HCl nhỏ nhất.
Hoạt động 2: Ý nghĩa của pH trong thực tiễn
HS thảo luận trả lời câu hỏi:
Trong thực tiễn, pH có ý nghĩa như thế nào?
Sản phẩm dự kiến:
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khỏe của con người, sự phát triển của động vật, thực vật,...
Hoạt động 3: Xác định pH
HS thảo luận trả lời câu hỏi:
Thế nào là chất chỉ thị acid – base?
Em hãy cho biết màu của giấy quỳ, pheolphthalein và giấy pH trong dung dịch pH.
Sản phẩm dự kiến:
- Chất chỉ thị acid – base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch
- Màu của giấy quỳ, phenolphthalein và giấy pH trong dung dịch ở các khoảng pH khác nhau:
+ Giấy quỳ:
pH 6: Đỏ
pH = 7: Tím
pH 8: Xanh
+ Phenolphthalein:
pH < 8: Không màu
pH > 8: Màu hồng
IV. SỰ THỦY PHÂN CỦA CÁC ION
HS thảo luận trả lời câu hỏi:
Trả lời câu hỏi mục IV SGK trang 24. Cho các dung dịch sau: Na2CO3, AlCl3, FeCl3
1. Dùng giấy pH xác định giá trị pH gần đúng của các dung dịch trên.
2. Nhận xét và giải thích về môi trường của các dung dịch trên. Em hãy trình bày ứng dụng dung dịch muối Na2CO3, AlCl3, FeCl3.
Sản phẩm dự kiến:
1.
AlCl3 | NaCl | FeCl3 | Na2CO3 | |
pH | < 7 | = 7 | < 7 | > 7 |
2.
- Xét dung dịch Na2CO3, ion Na+ không phản ứng với nước, còn ion CO32- thủy phân tạo môi trường base:
![]()
Vậy dung dịch Na2CO3 có môi trường base
- Xét dung dịch AlCl3 và FeCl3, ion Cl- không phản ứng với nước, còn ion Al3+ và Fe3+ thủy phân tạo môi trường acid:
Al3+ + H2O ⇌ Al(OH)2+ + H+
Fe3+ + H2O ⇌ Fe(OH)2+ + H+
Vậy các dung dịch AlCl3 và FeCl3 có môi trường acid
- Xét dung dịch NaCl, NaCl khi tan trong nước phân li thành các ion:
NaCl ⟶ Na+ + Cl-
Ứng dụng dung dịch muối Na2CO3, AlCl3, FeCl3:
- Na2CO3 được sử dụng trong công nghiệp thực phẩm, dệt, nhuộm, công nghiệp thủy tinh, silicate,...
- Phèn nhôm ((NH4)2SO4.Al2(SO4)3.24H2O) và phèn sắt ((NH4)2SO4.Fe2(SO4)3.24H2O) được sử dụng làm chất keo tụ trong quá trình xử lí nước
V. CHUẨN ĐỘ ACID – BASE
Hoạt động 1: Nguyên tắc
HS thảo luận trả lời câu hỏi:
Chuẩn độ là gì?
Thời điểm để kết thúc chuẩn độ được xác định như thế nào?
Sản phẩm dự kiến:
- Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
- Nồng độ của dung dịch base mạnh (NaOH) được xác định bằng một dung dịch acid mạnh (HCl) đã biết trước nồng độ mol dựa trên phản ứng:
NaOH + HCl ⟶ NaCl + H2O
Ta có: VHCl.CHCl = VNaOH.CNaOH
⟹ CNaOH=VHCl.CHClVNaOH
Trong đó:
CHCl và CNaOH lần lượt là nồng độ mol của dung dịch HCl và NaOH
VHCl và VNaOH lần lượt là thể tích của dung dịch HCl và dung dịch NaOH (cùng đơn vị đo)
- Thời điểm để kết thúc chuẩn độ được xác định bằng sự đổi màu của chất chỉ thị phenolphthalein
Hoạt động 2: Thực hành chuẩn độ acid – base
HS thảo luận trả lời câu hỏi:
Eam hãy nêu các bước tiến hành chuẩn độ acid – base.
Sản phẩm dự kiến:
- Tráng pipette và burette bằng chính dung dịch sẽ lấy
- Đọc thể tích dung dịch: lưu ý khi đọc thể tích dung dịch trong pipette, burette cần để ngang tầm mắt, đọc chỉ số vạch thẳng với mặt cong chất lỏng

- Chú ý không để bọt khí ở cuống burette
- Lưu ý khi cho dung dịch từ pipette vào bình tam giác: để pipette thẳng, nghiêng bình tam giác khoảng 45o, đầu pipette chạm vào thành bình, để dung dịch trong pipette chảy thành dòng
- Trong quá trình chuẩn độ, chú ý quan sát màu của dung dịch trong bình tam giác, khi dung dịch xuất hiện màu hồng nhạt bền trong 10 giây, lập tức dừng chuẩn độ
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Câu 2: Dung dịch X gồm : 0,09 mol Cl- , 0,04 mol Na+ , a mol Fe3+ và b mol SO42-Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05.
B. 0,03 và 0,02.
C. 0,07 và 0,08.
D. 0,018 và 0,027.
Câu 3: Các chất dẫn điện là
A. KCl nóng chảy, dung dịch NaOH, dung dịch HNO3.
B. dung dịch glucose , dung dịch ethyl alcohol, glycerol.
C. KCl rắn khan, NaOH rắn khan, kim cương.
D. Khí HCl, khí NO, khí O3.
Sản phẩm dự kiến:
Câu 1: C
Câu 2: B
Câu 3: A
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Cho các chất sau: HF; NaHCO3; H3PO4; CH3COOH; Na2S; ancol etylic; NH4Cl; CH3COOK; glucozơ; Al(OH)3; H2CO3; glyxerol; Cu(NO3)2; HNO3; NaOH. Xác định chất điện ly mạnh, chất điện ly yếu, chất không điện ly.
Câu 2: Viết phương trình điện li của acid yếu CH3COOH trong dung dịch. Nếu hòa tan ít tinh thể chất điện li mạnh CH3COONa vào dung dịch acid trên thì nồng độ H+ tăng hay giảm? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
