Giáo án và PPT Hoá học 11 kết nối Bài 6: Một số hợp chất của nitrogen với oxygen
Đồng bộ giáo án word và powerpoint (ppt) Bài 6: Một số hợp chất của nitrogen với oxygen. Thuộc chương trình Hoá học 11 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word








Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
BÀI 6: MỘT SỐ HỢP CHẤT CỦA NITROGEN VỚI OXYGEN
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Em hãy chia sẻ những hiểu biết của mình về mưa acid.
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. CÁC OXIDE CỦA NITROGEN
Hoạt động 1: Công thức, tên gọi
HS thảo luận trả lời câu hỏi:
- Kí hiệu chung các oxide của nitrogen là gì?
- Em hãy cho biết công thức và tên gọi của các hợp chát oxide của nitrogen có trong không khí.
Sản phẩm dự kiến:
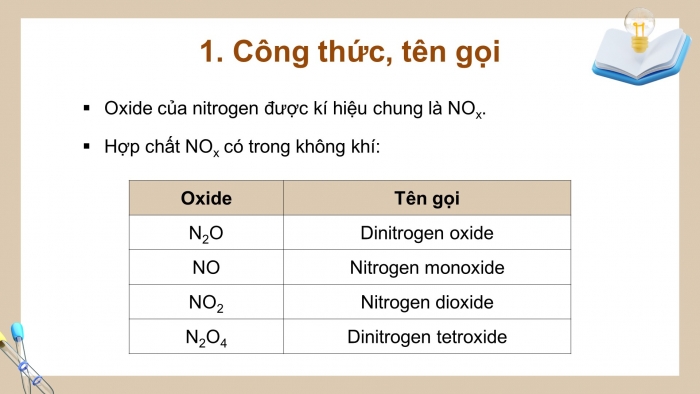
- Oxide của nitrogen được kí hiệu chung là NOx
- Hợp chất NOx có trong không khí:
Oxide | Tên gọi |
N2O | Dinitrogen oxide |
NO | Nitrogen monoxide |
NO2 | Nitrogen dioxide |
N2O4 | Dinitrogen tetroxide |
Hoạt động 2: Nguồn gốc phát sinh NOx trong không khí
HS thảo luận trả lời câu hỏi:
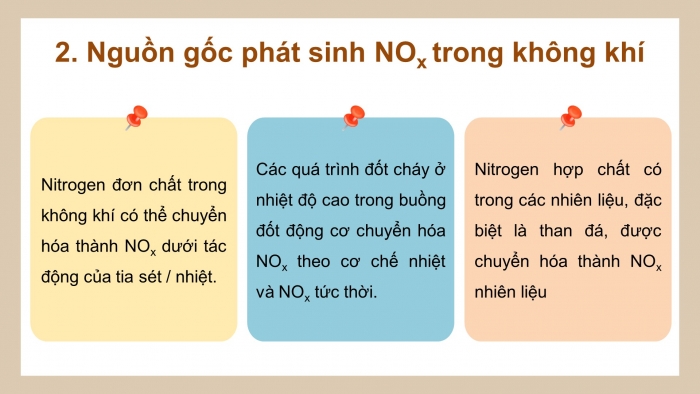
Em hãy trình bày nguyên nhân hình thành Nox trong không khí.
Sản phẩm dự kiến:
Bảng 6.1. Nguyên nhân hình thành NOx trong không khí
Loại NOx | Nguyên nhân tạo thành |
NOx nhiệt (thermal – NOx) | Nhiệt độ rất cao (trên 3 000 oC) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa: N2 + O2 ⇋ 2NO |
NOx nhiên liệu (fuel – NOx) | Nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen trong không khí |
NOx tức thời (prompt – NOx) | Nitrogen trong không khí tác dụng với các gốc tự do (gốc hydrocarbon, gốc hydroxyl,...) |
Hoạt động 3: Mưa acid
HS thảo luận trả lời câu hỏi:
- Mưa acid là gì?
- Tác nhân chính gây mưa acid là gì?
- Mưa acid gây ra những hệ quả gì?
- Nêu một số giải pháp nhằm giảm thiểu nguy cơ gây mưa acid.
Sản phẩm dự kiến:
- Mưa acid là hiện tượng khi nước mưa có pH nhỏ hơn 5,6
- Tác nhân chính gây mưa acid là SO2 và NOx:
2SO2 + O2 + 2H2O ![]() 2H2SO4
2H2SO4
4NO2 + O2 + 2H2O ![]() 4HNO3
4HNO3
- Mưa acid ảnh hưởng đến sinh vật, ăn mòn các công trình xây dựng, kiến trúc bằng đá và kim loại,...
- Một số giải pháp nhằm giảm thiểu nguy cơ gây mưa acid:
Xử lí khí thải các nhà máy nhiệt điện, luyện kim, đốt nhiên liệu,... trước khi thải ra môi trường
Tăng cường sử dụng năng lượng tái tạo
Kiểm soát chất lượng các phương tiện giao thông có động cơ.
II. NITRIC ACID
Hoạt động 1: Cấu tạo
HS thảo luận trả lời câu hỏi:
- Vẽ công thức Lewis và công thức cấu tạo của nitric acid.
- Nêu đặc điểm cấu tạo của phân tử nitric acid.
Sản phẩm dự kiến:
a) |
b) |
Hình 6.1. Công thức Lewis (a) và công thức cấu tạo (b) của nitric acid
Đặc điểm cấu tạo của phân tử nitric acid:
- Nguyên tử N có số oxi hóa +5, là số oxi hóa cao nhất của nitrogen
- Liên kết O – H phân cực mạnh về phía nguyên tử oxygen
- Liên kết N ⟶ O là liên kết cho – nhận
- Phân tử nitric acid có liên kết O – H phân cực mạnh ⟹ có khả năng phân li trong nước thành các ion ⟹ dễ tan
- Liên kết O – H phân cực mạnh ⟹ dễ cho proton ⟹ tính acid mạnh
- Nguyên tử N có số oxi hóa + 5 là số oxi hóa cao nhất ⟹ có khả năng nhận electron ⟹ thể hiện tính oxi hóa. Phân tử HNO3 có liên kết cho – nhận kém bền ⟹ khả năng hoạt động hóa học mạnh ⟹ tính oxi hóa mạnh
Hoạt động 2: Tính chất vật lí
HS thảo luận trả lời câu hỏi:
Em hãy nhận xét về tính chất vật lí của nitric acid.
Sản phẩm dự kiến:
Nitric acid tinh khiết là chất lỏng, không màu, bốc khói trong không khí ẩm và tan vô hạn trong nước
Hoạt động 3: Tính chất hóa học
HS thảo luận trả lời câu hỏi:
Trình bày tính chất hoá học của nitric acid.
Sản phẩm dự kiến:
Tính acid: Nitric acid có khả năng cho proton, thể hiện tính chất của một acid Br∅nsted – Lowry.
NH3 + HNO3 ⟶ NH4NO3
Tính oxi hóa: Nitric acid có khả năng nhận electron, thể hiện tính oxi hóa mạnh
Hoạt động 4: Ứng dụng nổi bật của nitric acid đặc
HS thảo luận trả lời câu hỏi:
Em hãy trình bày một số ứng dụng nổi bật của nitric acid đặc.
Sản phẩm dự kiến:
- Sản xuất thuốc nổ trinitrotoluene (TNT), nitroglycerin và thuốc súng không khói cellulose trinitrate.
- Tạo nước cường toan – aqua regia:
Au + HNO3 + 3HCl  AuCl3 + NO + 2H2O
AuCl3 + NO + 2H2O
HNO3 ![]() H+ + NO3-
H+ + NO3-
NaOH + HNO3![]() NaNO3 + H2O
NaNO3 + H2O
CaCO3 + 2HNO3 ![]() Ca(NO3)2 + CO2 + H2O
Ca(NO3)2 + CO2 + H2O
III. HIỆN TƯỢNG PHÚ DƯỠNG
HS thảo luận trả lời câu hỏi:
- Em hãy nêu nguyên nhân của hiện tượng phú dưỡng.
- Hiện tượng phú dưỡng gây ra những hệ quả gì?
- Nêu các biện pháp nhằm hạn chế hiện tượng phú dưỡng ở ao, hồ.
- Đề xuất cách cải tạo ao, hồ có hiện tượng phú dưỡng.
Sản phẩm dự kiến:
- Nguyên nhân của hiện tượng phú dưỡng là do sự dư thừa dinh dưỡng đã cung cấp nguồn thức ăn dồi dào cho sinh vật phù du phát triển rất mạnh
- Hệ quả:
+ Gây cản trở sự hấp thụ ánh sáng mặt trời vào nước, làm giảm sự quang hợp của thực vật thủy sinh
+ Rong, tảo phát triển mạnh gây thiếu nguồn oxygen trầm trọng cho các loài khác (đặc biệt là tôm, cá)
+ Gây mất cân bằng sinh thái
+ Xác rong, tảo phân hủy gây ô nhiễm môi trường nước, không khí và tạo chất bùn lắng xuống lòng ao, hồ.
- Các biện pháp nhằm hạn chế hiện tượng phú dưỡng ở ao, hồ: đắp cao bờ, ngăn chặn các đường dẫn nước thải vào ao, chống chảy tràn khi mưa lũ, cho thức ăn chăn nuôi đủ nhu cầu của vật nuôi.
- Đề xuất cách cải tạo ao, hồ có hiện tượng phú dưỡng: nạo, vét bùn, xác thực vật và tảo có trong ao
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Chất nào sau đây tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO?
A. Fe2O3.
B. FeO.
C. Fe(OH)3.
D. Fe2(SO4)3.
Câu 2: Nung nóng AgNO3 được chất rắn X và khí Y. Dẫn khí Y vào cốc nước được dung dịch Z. Cho toàn bộ X vào Z thấy X tan một phần và thoát ra khí NO duy nhất. Giả thiết các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của X không tan trong Z là
A. 20%.
B. 25%.
C. 30%.
D. 40%.
Câu 3: Cho hỗn hợp Al, Fe vào dung dịch HNO3 loãng, dư thu được 7,437 lít NO (là sản phẩm khử duy nhất của N+5ở đktc). Số mol acid đã phản ứng là
A. 0,3 mol.
B. 0,6 mol.
C. 1,2 mol.
D. 2,4 mol.
Sản phẩm dự kiến:
Câu 1: B
Câu 2: B
Câu 3: C
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Để nhận biết ion N trong dung dịch, có thể dùng kim loại nhôm khử ion N trong môi trường kiềm. Khi đó phản ứng tạo ra ion aluminum oxygen Al và giải phóng khí ammonia. Hãy viết phương trình hóa học ở dạng ion rút gọn.
Câu 2: Cho các thuốc thử Fe, CuO, Zn, Cu. Thuốc thử nào dùng để nhận biết ba acid đặc nguội HCl, H2SO4, HNO3 đựng riêng biệt trong ba lọ mất nhãn?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm


