Giáo án điện tử chuyên đề Hoá học 12 cánh diều Bài 5: Tìm hiểu về xử lí nước
Tải giáo án điện tử Chuyên đề học tập Hoá học 12 cánh diều Bài 5: Tìm hiểu về xử lí nước. Bộ giáo án chuyên đề được thiết kế sinh động, đẹp mắt. Thao tác tải về đơn giản, dễ dàng sử dụng và chỉnh sửa. Thầy, cô kéo xuống để xem chi tiết.
Xem: => Giáo án hoá học 12 cánh diều
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét









Xem toàn bộ: Giáo án điện tử chuyên đề hóa học 12 cánh diều
CHÀO MỪNG EM
ĐẾN VỚI BÀI HỌC HÔM NAY!
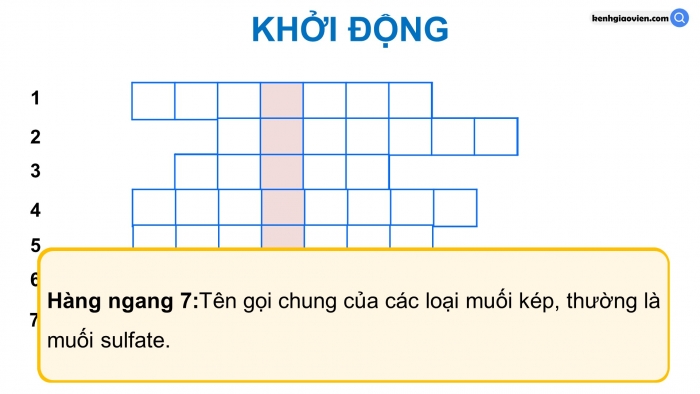
KHỞI ĐỘNG
1
2
| G | I | A | N | M | U | A |
| N | U | O | C | M | A | T |
| K | E | O | T | U |
| N | U | O | C | N | G | A | M |
| N | U | O | C | M | A | Y |
| P | A | C |
| P | H | E | N |
7
Hàng ngang 1:Nơi thực hiện quá trình kết tủa sắt ở nhà máy nước bằng cách cho nước mưa tiếp xúc với không khí
Hàng ngang 2:Tên gọi chung của nước sông, hồ, ao, ngòi.
Hàng ngang 3:Tên gọi của các tác nhân giúp kết tủa các hạt lơ lửng, làm trong nước.
Hàng ngang 4:Tên nguồn nước được lấy từ lòng đất để sản xuất nước sinh hoạt.
Hàng ngang 5: Tên loại nước sinh hoạt phổ biến hiện nay.
Hàng ngang 6:Tên tác nhân làm trong nước hiệu quả, được coi là bước đột phá trong công nghệ xử lí nước hiện nay.
Hàng ngang 7:Tên gọi chung của các loại muối kép, thường là muối sulfate.
XỬ LÍ NƯỚC
SINH HOẠT
BÀI 5
NỘI DUNG BÀI HỌC
01
Khái quát về xử lí nước sinh hoạt
02
Vật liệu và hóa chất thông dụng được sử dụng để xử lí nước
I. KHÁI QUÁT VỀ XỬ LÍ NƯỚC SINH HOẠT
1. Nước sinh hoạt
Nước sinh hoạt là gì?
Nước đã qua xử lí có chất lượng bảo đảm, đáp ứng tiêu chuẩn phù hợp mục đích ăn uống, vệ sinh của con người.
KHÁI NIỆM
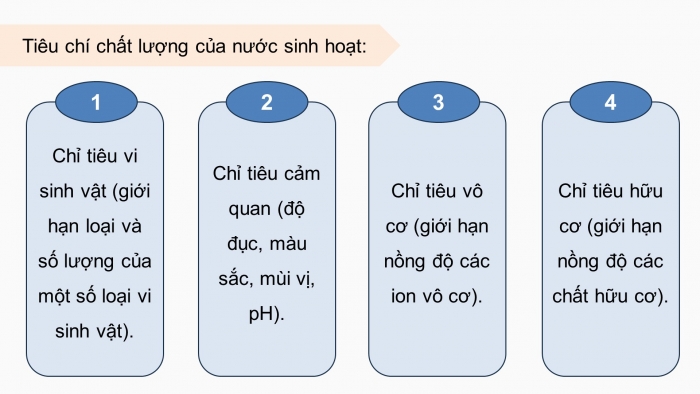
Tiêu chí chất lượng của nước sinh hoạt:
Chỉ tiêu vi sinh vật (giới hạn loại và số lượng của một số loại vi sinh vật).
1
Chỉ tiêu cảm quan (độ đục, màu sắc, mùi vị, pH).
2
Chỉ tiêu vô cơ (giới hạn nồng độ các ion vô cơ).
3
Chỉ tiêu hữu cơ (giới hạn nồng độ các chất hữu cơ).
4
Nêu những ảnh hưởng nếu chúng ta sử dụng nguồn nước không sạch cho sinh hoạt.
Khi nguồn nước sinh hoạt bị nhiễm bẩn, tùy theo mức độ, có thể gây nên các bệnh ngoài da như mẩn ngứa, dị ứng, viêm loét; có thể gây ra các bệnh về truyền nhiễm như kiết lị, thương hàn, dịch tả và các bệnh do các kim loại nặng (lead, arsenic,..).
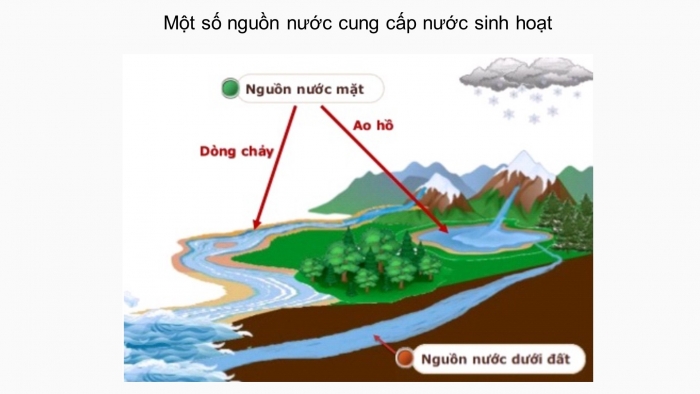
Các nguồn cấp nước cho sinh hoạt: nước ngầm; nước mưa và nước từ sông suối, ao, hồ; nước đã qua xử lí của nhà máy cấp nước.
Một số nguồn nước cung cấp nước sinh hoạt
Nêu một số nguồn cấp nước sinh hoạt.
Xử lí nước là quá trình làm thay đổi thành phần, tính chất của các nguồn nước tự nhiên khác nhau thành nước sạch.
Nguồn nước tự nhiên để xử lí thành nước sinh hoạt thường là nước mặt (nước sông, nước hồ) hoặc nước ngầm (nước giếng khoan, nước giếng đào).
Câu hỏi 1: Theo em, những ion của kim loại và vi sinh vật có hại nào thường có trong các nguồn nước tự nhiên?
Các ion kim loại thường có trong nguồn nước tự nhiên như Cd2+, Fe2+ và Fe3+, Pb2+….; vi sinh vật có hại như Coliform tổng số, E.coli hoặc Coliform chịu nhiệt,…
II. VẬT LIỆU VÀ HÓA CHẤT THÔNG DỤNG ĐƯỢC SỬ DỤNG ĐỂ XỬ LÍ NƯỚC
1. Hóa chất, vật liệu làm giảm độ đục, khử màu và giảm nồng độ một số ion trong xử lí nước
Một số vật liệu lọc nước
Hãy cho biết một số loại vật liệu dùng trong xử lí nước.
- Một số vật liệu dùng trong xử lí nước là cát, đá, sỏi.
- Ngoài vật liệu cát, một bộ lọc đơn giản cần sử dụng than hoặc than hoạt tính, sỏi, đá,… Trong đó, than và than hoạt tính có tác dụng khử mùi hiệu quả.
- Chất rắn lơ lửng có kích thước nhỏ, nhẹ, lắng chậm hoặc lắng không hoàn toàn xuống đáy vật chứa làm cho nước bị đục.
- Các chất vô cơ, hữu cơ, thực vật phù du, tảo,… làm cho nước có màu.
- Ca2+, Mg2+ vượt nồng độ quy định gây nên tính cứng của nước, Fe2+ và Fe3+ gây hiện tượng nổi váng nâu đỏ trên mặt nước khi tiếp xúc với không khí, H+ ảnh hưởng đến pH của nước,…
GHI NHỚ
| Vật liệu, hóa chất | Thành phần chính
| Vai trò
|
| Sỏi, cát, đá | Các khoáng vật silicate. | Tách, lọc tạp chất có kích thước nhỏ khỏi nước để làm giảm độ đục của nước. |
| Than hoạt tính | Carbon. | Hấp phụ chất rắn lơ lửng có kích thước bé và một số chất vào bên trong hạt than, làm trong nước, khử màu và khử mùi của nước. |
| Phèn nhôm – kali và phèn nhôm - ammonium | K2SO4.Al2(SO4)3.24H2O. (NH4)2SO4.Al2(SO4)3.24H2O. | Thủy phân tạo chất không tan dạng keo để kết dính các hạt lơ lửng trong nước rồi lắng xuống đáy, giúp làm trong nước. |
| Poly(aluminium chloride) hay PAC | [Al2(OH)mCl6-m]n |
QUAN SÁT HÌNH ẢNH
Mô hình xử lí nước đơn giản
Ngoài cát, một bộ lọc đơn giản cần thêm vật liệu nào? Loại nào có tác dụng khử mùi?
PHIẾU BÀI TẬP
Câu 1: Nếu chứa cation Cu2+ với nồng độ đáng kể thì nước có thể có màu gì?
Nước có thể có màu xanh.
Câu 2: Viết phương trình hóa học của quá trình thủy phân diễn ra khi cho phèn nhôm - ammonium.
Khi cho phèn nhôm – ammonium ((NH4)2SO4.Al2(SO4)3.24H2O) vào nước, phèn nhôm – ammonium sẽ phân li hoàn toàn theo phương trình:
(NH4)2SO4.Al2(SO4)3.24H2O →2+ 4 + 2Al3+ + 24H2O
PHIẾU BÀI TẬP
Câu 1: Nếu chứa cation Cu2+ với nồng độ đáng kể thì nước có thể có màu gì?
Nước có thể có màu xanh.
Câu 2: Viết phương trình hóa học của quá trình thủy phân diễn ra khi cho phèn nhôm - ammonium.
Sau đó các ion NH4+ và Al3+ bị thuỷ phân:
+ H2O ⇌ NH3 + H3O+
Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
Câu 3: Một mẫu nước giếng vừa đục, vừa có màu. Hãy đề xuất cách làm cụ thể để giảm độ đục và màu sắc của nước.
Bước 1: Làm giảm độ đục của nước:
Chuẩn bị:
- Hoá chất: Phèn nhôm – kali, mẫu nước giếng bị đục và có màu.
- Dụng cụ: Cốc thuỷ tinh thể tích 100 mL, giấy đo pH, ống hút nhỏ giọt, đũa thuỷ tinh.
Câu 3: Một mẫu nước giếng vừa đục, vừa có màu. Hãy đề xuất cách làm cụ thể để giảm độ đục và màu sắc của nước.
Tiến hành:
- Hoà tan khoảng 50 – 60 mg phèn nhôm – kali trong 1 L nước sạch.
- Cho khoảng 60 – 70 mL nước giếng bị đục vào một cốc thuỷ tinh.
- Xác định pH của nước trong cốc bằng giấy đo pH.
- Nhỏ khoảng 10 giọt dung dịch phèn nhôm – kali vào cốc. Dùng đũa thuỷ tinh khuấy đều dung dịch trong cốc. Sau khoảng 2 phút thì dừng khuấy và để yên trong khoảng 2 phút. Kiểm tra lại pH của dung dịch trong cốc này bằng giấy đo pH.
Câu 3: Một mẫu nước giếng vừa đục, vừa có màu. Hãy đề xuất cách làm cụ thể để giảm độ đục và màu sắc của nước.
Bước 2: Làm giảm màu sắc của nước
Chuẩn bị:
- Hoá chất: Cốc chứa nước giếng vừa được làm giảm độ đục ở bước 1.
- Vật liệu: Bông, sỏi, cát, than hoạt tính mịn (hoặc than gỗ).
- Dụng cụ: Xy-lanh 25 mL, cốc thuỷ tinh nhỏ, giá sắt.
- Tạo cột lọc: Cho lần lượt từng lớp vật liệu vào xy-lanh theo thứ tự: bông, than hoạt tính mịn, cát, sỏi. Trong đó, bề dày lớp than khoảng 3 cm và bề dày mỗi lớp vật liệu còn lại
Câu 4: Trong Thí nghiệm 1, sau khi làm giảm độ đục của nước, có thể dùng hóa chất phổ biến nào để làm tăng pH của nước?
Trong thí nghiệm 1, sau khi làm giảm độ đục của nước, có thể dùng hoá chất phổ biến là soda (Na2CO3, sodium carbonate) để làm tăng pH của nước.
Câu 5: Trong nuôi thủy, hải sản, người ta có thể dùng phèn chua để làm giảm độ đục của nước do sinh vật phù du, thức ăn thừa, chất thải từ vật nuôi,… gây ra. Sau khi dùng phèn chua, nếu pH của nước giảm xuống thấp hơn quy định, người ta có thể cho nước vôi trong hoặc dung dịch soda vào nước. Giải thích cách xử lí trên.
- Điều chỉnh pH bằng cách làm tăng pH, cụ thể: Khi cho phèn chua (hay phèn nhôm – kali) vào nước, xảy ra quá trình phân li hoàn toàn (câu 2). Do quá trình thuỷ phân Al3+ sinh ra ion H+ nên làm pH của nước giảm so với ban đầu.
- Để làm tăng pH của nước người ta có thể cho nước vôi trong hoặc dung dịch soda vào nước vì:
- Khi cho nước vôi trong vào nước: Ca(OH)2 → Ca2+ + OH−
- Khi cho dung dịch soda vào nước: Na2CO3 → 2Na+ +
2. Hóa chất xử lí sinh học
Quan sát hình ảnh
Tại sao cần xử lí sinh học nước sinh hoạt?
Chloramine B
Clorua vôi
Vai trò của hai loại hóa chất này trong xử lí nước sinh hoạt là gì?
Trong nước thường có các vi khuẩn có hại; nhiều chất hữu cơ tan trong nước thường là thức ăn của vi sinh vật, giúp vi sinh vật phát triển nên làm tăng nguy cơ nước bị nhiễm khuẩn
⇒ Nước cần được xử lí chất hữu cơ hòa tan và vi sinh vật.
VAI TRÒ
| Hóa chất | Công thức | Vai trò |
| Clorua vôi | CaOCl2 | Sát khuẩn, khử trùng, oxi hóa chất hữu cơ có trong nước. |
| Chloramine B | C6H5SO2NClNa.3H2O |
Trong xử lí sinh học, cùng với việc sử dụng các hóa chất như clorua vôi, chloramine B, người ta còn kết hợp với việc chiếu tia tử ngoại hoặc sục khí ozone vào nước.
Mục đích của công đoạn đó nhằm oxi hóa Fe2+ thành Fe3+ rồi chuyển thành Fe(III) không tan.
Tại các nhà máy xử lí nước, trước khi làm giảm độ đục của nước, nước cần được cho vào bể nông, có diện tích bề mặt lớn, có hệ thống khuấy trộn nước. Tìm hiểu và cho biết mục đích của công đoạn này.
LUYỆN TẬP
PHIẾU BÀI TẬP
Câu 1. Giới hạn loại và số lượng của một số loại vi sinh vật thuộc chỉ tiêu
A. cảm quan. B. vi sinh vật. C. vô cơ. D. hữu cơ.
Câu 2. Nước nào sau đây không phải nước mặt?
--------------- Còn tiếp ---------------
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử chuyên đề hóa học 12 cánh diều
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 12 CÁNH DIỀU
Giáo án hoạt động trải nghiệm hướng nghiệp 12 cánh diều
Giáo án Tin học 12 - Định hướng khoa học máy tính cánh diều
Giáo án Tin học 12 - Định hướng Tin học ứng dụng cánh diều
GIÁO ÁN POWERPOINT LỚP 12 CÁNH DIỀU
Giáo án Powerpoint Toán 12 Cánh diều
Giáo án powerpoint hình học 12 cánh diều
Giáo án powerpoint đại số 12 cánh diều
Giáo án powerpoint vật lí 12 cánh diều
Giáo án powerpoint sinh học 12 cánh diều
Giáo án powerpoint hoá học 12 cánh diều
Giáo án powerpoint ngữ văn 12 cánh diều
Giáo án powerpoint lịch sử 12 cánh diều
Giáo án powerpoint địa lí 12 cánh diều
Giáo án powerpoint Kinh tế pháp luật 12 cánh diều
Giáo án powerpoint Công nghệ 12 Công nghệ điện - điện tử cánh diều
Giáo án powerpoint Công nghệ 12 Lâm nghiệp - Thuỷ sản cánh diều
Giáo án powerpoint Tin học 12 - Định hướng Tin học ứng dụng cánh diều
Giáo án powerpoint Tin học 12 - Định hướng khoa học máy tính cánh diều
Giáo án powerpoint hoạt động trải nghiệm hướng nghiệp 12 cánh diều
GIÁO ÁN CHUYÊN ĐỀ LỚP 12 CÁNH DIỀU
GIÁO ÁN POWERPOINT CHUYÊN ĐỀ 12 CÁNH DIỀU
GIÁO ÁN DẠY THÊM LỚP 12 CÁNH DIỀU
Giáo án dạy thêm toán 12 cánh diều
Giáo án dạy thêm ngữ văn 12 cánh diều
Giáo án powerpoint dạy thêm ngữ văn 12 cánh diều
Giáo án powerpoint dạy thêm toán 12 cánh diều
