Giáo án điện tử chuyên đề Hoá học 12 cánh diều Bài 6: Một số khái niệm cơ bản về phức chất
Tải giáo án điện tử Chuyên đề học tập Hoá học 12 cánh diều Bài 6: Một số khái niệm cơ bản về phức chất. Bộ giáo án chuyên đề được thiết kế sinh động, đẹp mắt. Thao tác tải về đơn giản, dễ dàng sử dụng và chỉnh sửa. Thầy, cô kéo xuống để xem chi tiết.
Xem: => Giáo án hoá học 12 cánh diều
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét






Xem toàn bộ: Giáo án điện tử chuyên đề hóa học 12 cánh diều
RẤT VUI ĐƯỢC GẶP LẠI
CÁC EM TRONG TIẾT HỌC HÔM NAY!
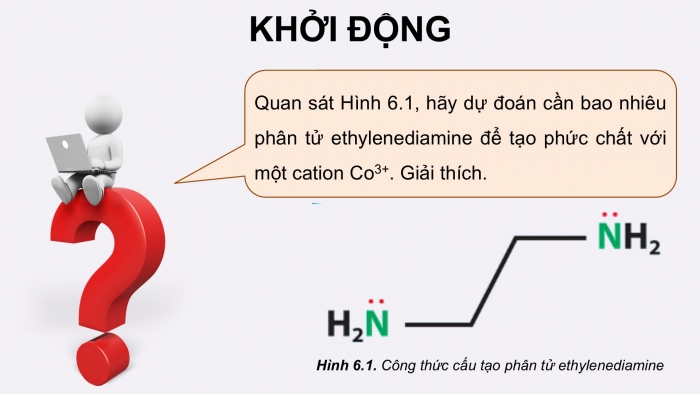
KHỞI ĐỘNG
Quan sát Hình 6.1, hãy dự đoán cần bao nhiêu phân tử ethylenediamine để tạo phức chất với một cation Co3+. Giải thích.
Hình 6.1. Công thức cấu tạo phân tử ethylenediamine
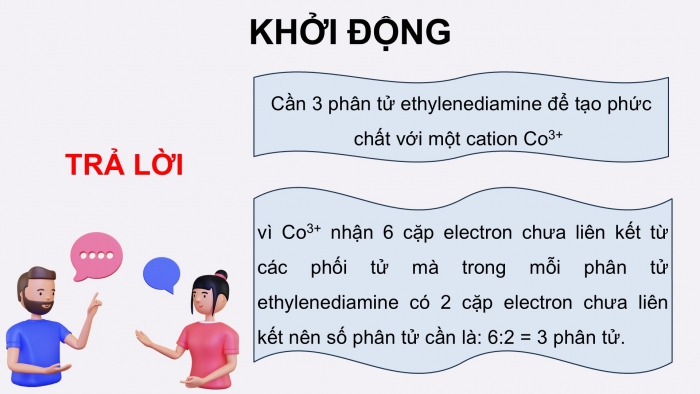
KHỞI ĐỘNG
Cần 3 phân tử ethylenediamine để tạo phức chất với một cation Co3+
vì Co3+ nhận 6 cặp electron chưa liên kết từ các phối tử mà trong mỗi phân tử ethylenediamine có 2 cặp electron chưa liên kết nên số phân tử cần là: 6:2 = 3 phân tử.
TRẢ LỜI
CHUYÊN ĐỀ 3: MỘT SỐ VẤN ĐỀ CƠ BẢN VỀ PHỨC CHẤT
BÀI 6: MỘT SỐ VẤN ĐỀ CƠ BẢN VỀ PHỨC CHẤT
NỘI DUNG BÀI HỌC
I.
Nguyên tử trung tâm và số phối trí của nguyên tử trung tâm trong phức chất
II.
Phối tử và dung lượng phối trí của phối tử trong phức chất
NGUYÊN TỬ TRUNG TÂM VÀ SỐ PHỐI TRÍ CỦA NGUYÊN TỬ TRUNG TÂM TRONG PHỨC CHẤT
I.
THẢO LUẬN CẶP ĐÔI
Cho biết nguyên tử trung tâm trong phức chất thường được hình thành từ phần tử nào trong các phần tử sau đây: cation kim loại, anion, nguyên tử kim loại hay phân tử? Cho ví dụ minh họa.
Số phối trí của nguyên tử trung tâm trong phức chất là gì? Cho ví dụ minh họa.
Một loại nguyên tử trung tâm (chẳng hạn như nguyên tử trung tâm cobalt) chỉ có một giá trị số phối trí hay có thể có nhiều giá trị về số phối trí? Cho ví dụ minh họa.
TRẢ LỜI
Nguyên tử trung tâm trong phức chất được hình thành từ cation kim loại hoặc nguyên tử kim loại.
VÍ DỤ
Phức chất [Fe(CN)6]3- có nguyên tử trung tâm là Fe3+.
VD1
Phức chất [Cu(NH3)4]2+ có nguyên tử trung tâm là Cu2+.
VD2
TRẢ LỜI
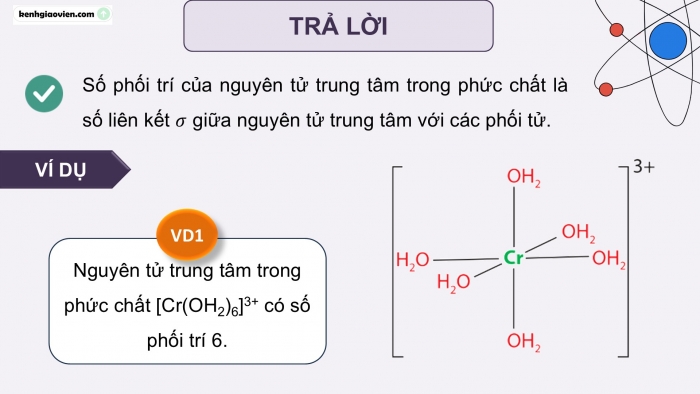
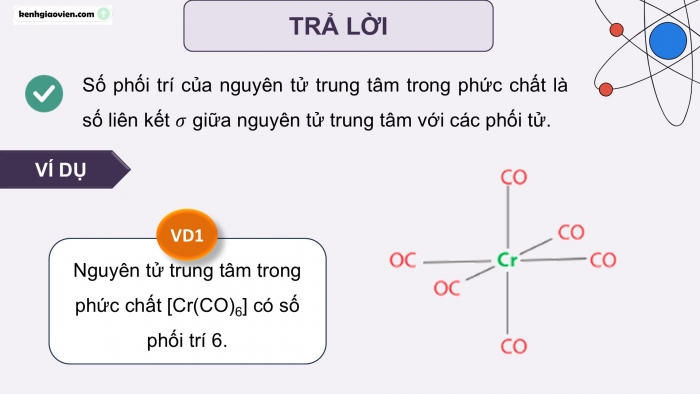
Số phối trí của nguyên tử trung tâm trong phức chất là số liên kết giữa nguyên tử trung tâm với các phối tử.
VÍ DỤ
Nguyên tử trung tâm trong phức chất [Cr(OH2)6]3+ có số phối trí 6.
VD1
TRẢ LỜI
Số phối trí của nguyên tử trung tâm trong phức chất là số liên kết giữa nguyên tử trung tâm với các phối tử.
VÍ DỤ
Nguyên tử trung tâm trong phức chất [Cr(CO)6] có số phối trí 6.
VD1
TRẢ LỜI
Số phối trí của nguyên tử trung tâm trong mỗi phức chất có thể thay đổi tùy điều kiện cụ thể và được xác định từ thực nghiệm.
VÍ DỤ
Số phối trí là 4 trong phức chất [CoCl4]2-
VD1
Số phối trí là 6 trong phức chất [Co(NH3)6]3+
VD2
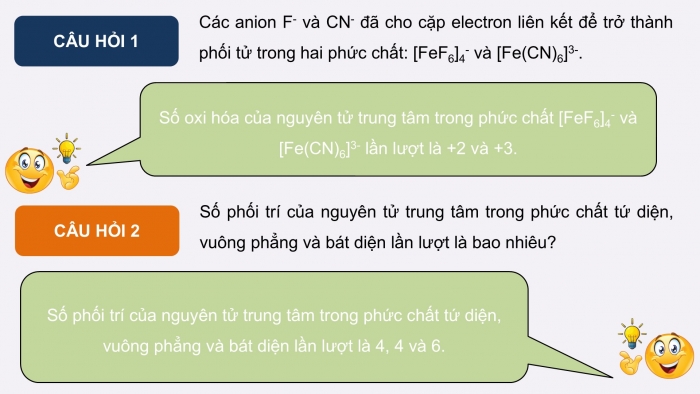
CÂU HỎI 1
Các anion F- và CN- đã cho cặp electron liên kết để trở thành phối tử trong hai phức chất: [FeF6]4- và [Fe(CN)6]3-.
CÂU HỎI 2
Số phối trí của nguyên tử trung tâm trong phức chất tứ diện, vuông phẳng và bát diện lần lượt là bao nhiêu?
Số oxi hóa của nguyên tử trung tâm trong phức chất [FeF6]4- và [Fe(CN)6]3- lần lượt là +2 và +3.
Số phối trí của nguyên tử trung tâm trong phức chất tứ diện, vuông phẳng và bát diện lần lượt là 4, 4 và 6.
LUYỆN TẬP VÀ VẬN DỤNG
Cho biết số oxi hóa của nguyên tử trung tâm trong hai phức chất sau: [Ni(CO)4] và [NiCl4]2-.
Hãy cho biết số phối trí của nguyên tử trung tâm trong phức chất [Ni(OH2)6]2+ và phức chất [NiCl4]2-.
Số oxi hóa của nguyên tử trung tâm trong hai phức chất sau: [Ni(CO)4] và [NiCl4]2- lần lượt là 0 và +2.
Số phối trí của nguyên tử trung tâm trong phức chất [Ni(OH2)6]2+ và phức chất [NiCl4]2- lần lượt là 6 và 4.
PHỐI TỬ VÀ DUNG LƯỢNG PHỐI TRÍ CỦA PHỐI TỬ TRONG PHỨC CHẤT
II.
Đọc thông tin mục SGK trang 39 – 40 , thực hiện nhiệm vụ:
THẢO LUẬN NHÓM ĐÔI
Cho biết phối tử trong phức chất thường được hình thành từ tiểu phân nào trong các tiểu phân sau đây: cation kim loại, anion, nguyên tử kim loại hay phân tử? Cho ví dụ minh họa.
1
Dung lượng phối trí của phối tử trong phức chất là gì? Cho ví dụ minh họa.
2
Cho ví dụ phức chất chứa cả phối tử có dung lượng phối trí 1 và phối tử có dung lượng phối trí 2.
Ví dụ:
- Phức chất [Fe(CN)6]3- có phối tử là CN-.
- Phức chất [Cu(NH3)4]2+ có phối tử là NH3.
- Phối tử trong phức chất thường được hình thành từ anion hoặc phân tử trung hòa còn cặp electron chưa liên kết có khả năng cho nguyên tử trung tâm.
TRẢ LỜI
- Dung lượng phối trí của phối tử là số liên kết giữa một phối tử đó với nguyên tử trung tâm.
TRẢ LỜI
Ammonia (NH3 ) cho nguyên tử trung tâm một cặp electron chưa liên kết của nguyên tử N để hình thành một liên kết theo kiểu cho – nhận nên phối tử NH3 có dung lượng phối trí 1.
VÍ DỤ 1
- Dung lượng phối trí của phối tử là số liên kết giữa một phối tử đó với nguyên tử trung tâm.
TRẢ LỜI
Ethylenediamine ( ) thường cho nguyên tử trung tâm hai cặp electron chưa liên kết của cả hai nguyên tử N để hình thành hai liên kết theo kiểu cho – nhận nên có dung lượng phối trí
VÍ DỤ 2
Mỗi loại phối tử trong phức chất ở Hình 6.2 có dung lượng phối trí là bao nhiêu?
TRẢ LỜI
Mỗi loại phối tử trong phức chất ở Hình 6.2 có dung lượng phối trí là:
- Cl- có dung lượng phối trí là 1.
- Ethylenediamine (en) có dung lượng phối trí là 2.
--------------------------------------
--------------------- Còn tiếp ----------------------
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử chuyên đề hóa học 12 cánh diều
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 12 CÁNH DIỀU
Giáo án hoạt động trải nghiệm hướng nghiệp 12 cánh diều
Giáo án Tin học 12 - Định hướng khoa học máy tính cánh diều
Giáo án Tin học 12 - Định hướng Tin học ứng dụng cánh diều
GIÁO ÁN POWERPOINT LỚP 12 CÁNH DIỀU
Giáo án Powerpoint Toán 12 Cánh diều
Giáo án powerpoint hình học 12 cánh diều
Giáo án powerpoint đại số 12 cánh diều
Giáo án powerpoint vật lí 12 cánh diều
Giáo án powerpoint sinh học 12 cánh diều
Giáo án powerpoint hoá học 12 cánh diều
Giáo án powerpoint ngữ văn 12 cánh diều
Giáo án powerpoint lịch sử 12 cánh diều
Giáo án powerpoint địa lí 12 cánh diều
Giáo án powerpoint Kinh tế pháp luật 12 cánh diều
Giáo án powerpoint Công nghệ 12 Công nghệ điện - điện tử cánh diều
Giáo án powerpoint Công nghệ 12 Lâm nghiệp - Thuỷ sản cánh diều
Giáo án powerpoint Tin học 12 - Định hướng Tin học ứng dụng cánh diều
Giáo án powerpoint Tin học 12 - Định hướng khoa học máy tính cánh diều
Giáo án powerpoint hoạt động trải nghiệm hướng nghiệp 12 cánh diều
GIÁO ÁN CHUYÊN ĐỀ LỚP 12 CÁNH DIỀU
GIÁO ÁN POWERPOINT CHUYÊN ĐỀ 12 CÁNH DIỀU
GIÁO ÁN DẠY THÊM LỚP 12 CÁNH DIỀU
Giáo án dạy thêm toán 12 cánh diều
Giáo án dạy thêm ngữ văn 12 cánh diều
Giáo án powerpoint dạy thêm ngữ văn 12 cánh diều
Giáo án powerpoint dạy thêm toán 12 cánh diều
