Giáo án kì 2 Hoá học 12 chân trời sáng tạo
Đầy đủ giáo án kì 2, giáo án cả năm Hoá học 12 chân trời sáng tạo. Bộ giáo án chất lượng, chỉn chu, được hỗ trợ tốt nhất hiện nay. Khi mua giáo án được tặng thêm: bộ phiếu trắc nghiệm, bộ đề kiểm tra theo cấu trúc mới. Giáo án được gửi ngay và luôn. Có thể xem trước bất kì bài nào phía dưới trước khi mua.
Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
I. GIÁO ÁN WORD KÌ 2 HÓA HỌC 12 CHÂN TRỜI SÁNG TẠO
- Giáo án Hoá học 12 chân trời Bài 12: Thế điện cực và nguồn điện hoá học
- Giáo án Hoá học 12 chân trời Bài 13: Điện phân
- Giáo án Hoá học 12 chân trời Bài 14: Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại
- Giáo án Hoá học 12 chân trời Bài 15: Các phương pháp tách kim loại
- Giáo án Hoá học 12 chân trời Bài 16: Hợp kim – Sự ăn mòn kim loại
- Giáo án Hoá học 12 chân trời Bài 17: Nguyên tố nhóm IA
- Giáo án Hoá học 12 chân trời Bài 18: Nguyên tố nhóm IIA
- Giáo án Hoá học 12 chân trời Bài 19: Đại cương về kim loại chuyển tiếp dãy thứ nhất
- Giáo án Hoá học 12 chân trời Bài 20: Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
- Giáo án Hoá học 12 chân trời Bài Ôn tập Chương 5
- Giáo án Hoá học 12 chân trời Bài Ôn tập Chương 6
- Giáo án Hoá học 12 chân trời Bài Ôn tập Chương 7
- Giáo án Hoá học 12 chân trời Bài Ôn tập Chương 8
Ngày soạn:…/…/…
Ngày dạy:…/…/…
BÀI 13. ĐIỆN PHÂN
I. MỤC TIÊU
1. Về kiến thức
Sau bài học này, HS sẽ:
- Trình bày được nguyên tắc (thứ tự) điện phân dung dịch, điện phân nóng chảy.
- Thực hiện được (hoặc quan sát video) thí nghiệm điện phân dung dịch copper (II) sulfate, dung dịch sodium chloride (tự chế tạo nước Javel để tẩy rửa).
- Nêu được ứng dụng của một số hiện tượng điện phân trong thực tiễn (mạ điện, tinh chế kim loại).
- Trình bày được giai đoạn điện phân aluminium oxide trong sản xuất nhôm (aluminium), tinh luyện đồng (copper) bằng phương pháp điện phân, mạ điện.
2. Năng lực
Năng lực chung:
- Năng lực giao tiếp và hợp tác: Chủ động giao tiếp trong nhóm, trình bày rõ ý tưởng cá nhân và hỗ trợ nhau hoàn thành nhiệm vụ chung, tự tin và biết kiểm soát cảm xúc, thái độ khi nói trước nhiều người.
- Năng lực giải quyết vấn đề và sáng tạo: Thu thập và làm rõ thông tin có liên quan đến vấn đề; phân tích để xây dựng được các ý tưởng phù hợp.
Năng lực đặc thù:
- Năng lực vận dụng kiến thức, kĩ năng đã học: Nhận ra, giải thích được vấn đề thực tiễn dựa trên kiến thức hoá học.
- Năng lực tìm hiểu tự nhiên dưới góc độ hoá học:
- Sử dụng được ngôn ngữ, hình vẽ, sơ đồ, biểu bảng để biểu đạt quá trình tìm hiểu vấn đề và kết quả tìm kiếm.
- Viết được báo cáo quá trình tìm hiểu.
- Năng lực nhận thức hoá học:
- Trình bày được nguyên tắc (thứ tự) điện phân dung dịch, điện phân nóng chảy.
- Thực hiện được (hoặc quan sát video) thí nghiệm điện phân dung dịch copper (II) sulfate, dung dịch sodium chloride (tự chế tạo nước Javel để tẩy rửa).
- Nêu được ứng dụng của một số hiện tượng điện phân trong thực tiễn (mạ điện, tinh chế kim loại).
- Trình bày được giai đoạn điện phân aluminium oxide trong sản xuất nhôm (aluminium), tinh luyện đồng (copper) bằng phương pháp điện phân, mạ điện.
3. Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn trọng, trung thực và thực hiện các yêu cầu trong bài học.
- Sử dụng tiết kiệm, an toàn các sản phẩm của quá trình luyện kim trong đời sống, sản xuất.
- Có ý thức thu gom, phân loại các loại phế thải kim loại sau khi sử dụng đúng quy định để bảo vệ môi trường.
- Khơi dậy ý thức tìm kiếm các tài nguyên, vật liệu thân thiện với môi trường.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với giáo viên
- Tài liệu: SGK, SGV Hóa học 12, các hình ảnh liên quan đến bài học.
- Thiết bị dạy học: Máy tính, máy chiếu.
- Hóa chất và dụng cụ thực hiện các thí nghiệm trong bài.
2. Đối với học sinh
- Tài liệu: SGK Hóa học 12.
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu:
- Huy động được vốn hiểu biết, kĩ năng có sẵn của học sinh (về chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử, điện cực, thế điện cực chuẩn) để chuẩn bị cho bài học mới; học sinh cảm thấy vấn đề sắp học rất gần gũi với mình.
- Kích thích sự tò mò, khơi dậy hứng thú của học sinh về chủ đề sẽ học; tạo không khí lớp học sôi nổi, chờ đợi, thích thú.
- Học sinh trải nghiệm qua tình huống có vấn đề, trong đó chứa đựng những nội dung kiến thức, những kĩ năng để phát triển phẩm chất, năng lực mới.
b. Nội dung: GV tổ chức cho HS trả lời câu hỏi để tìm các từ hàng ngang, từ đó tìm được từ khóa liên quan đến bài học.
c. Sản phẩm: HS tìm được từ khóa liên quan đến bài học.
d. Tổ chức thực hiện
Bước 1: GV chuyển giao nhiệm vụ học tập
- GV tổ chức cho HS tham gia trò chơi ô chữ, yêu cầu: Em hãy trả lời các câu hỏi sau để tìm được từ thích hợp điền vào các hàng ngang tương ứng, từ đó xác định được từ khóa.
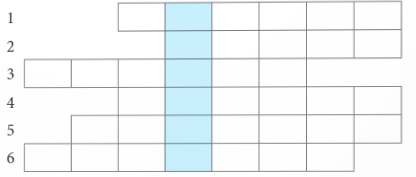
Câu 1: Thiết bị nào dùng để đo cường độ dòng điện?
Câu 2: Theo quy ước với cả pin điện và bình điện phân, điện cực nào là nơi xảy ra quá trình oxi hóa?
Câu 3: Vật liệu dẫn điện được sử dụng để kết nối các thành phần điện tử với nhau, tạo thành mạch điện gọi là gì?
Câu 4: Hiện tượng các chất tan vào nước và phân li thành các ion mang điện gọi là gì?
Câu 5: Trong pin điện hoặc bình điện phân, nơi xảy ra quá trình oxi hóa và quá trình khử gọi là gì?
Câu 6: Loại phản ứng nào biến một chất thành hai hay nhiều chất?
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS làm việc cá nhân, tham gia trò chơi và suy nghĩ trả lời câu hỏi của GV.
- GV hướng dẫn, hỗ trợ HS (nếu cần thiết).
Bước 3: Báo cáo kết quả hoạt động, thảo luận
- GV mời 2 – 3 HS trả lời câu hỏi:
Câu 1: Ampe kế.
Câu 2: Anode.
Câu 3: Dây dẫn.
Câu 4: Điện li.
Câu 5: Điện cực.
Câu 6: Phân hủy.
Từ khóa: Mạ điện.
- Các HS khác lắng nghe để nhận xét câu trả lời của bạn mình.
- GV khuyến khích HS có thể có nhiều ý kiến khác nhau.
- GV cung cấp thêm thông tin về từ khóa: Mạ điện là một ứng dụng quan trọng của hiện tượng điện phân nhằm trang trí bề mặt hoặc chống sự ăn mòn.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV đánh giá, nhận xét của câu trả lời HS, dẫn dắt HS vào bài học: Pin điện hóa hoạt động dựa trên các phản ứng oxi hóa – khử tự xảy ra trong pin (hóa năng chuyển thành điện năng). Tuy nhiên, một số phản ứng oxi hóa – khử chỉ có thể xảy ra nhờ dòng điện (trong đó có mạ điện), được gọi là phản ứng điện phân (điện năng chuyển thành hóa năng). Khi điện phân, các quá trình trên bề mặt điện cực xảy ra theo nguyên tắc nào? Điện phân có ứng dụng gì trong đời sống, sản xuất? Để đi tìm câu trả lời, chúng ta cùng vào bài học ngày hôm nay Bài 13 – Điện phân.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1. Điện phân nóng chảy, điện phân dung dịch
a. Mục tiêu:
- HS trình bày được nguyên tắc điện phân dung dịch, điện phân nóng chảy.
b. Nội dung: HS đọc các thông tin trong SGK và thực hiện yêu cầu của GV.
c. Sản phẩm: Câu trả lời của HS. HS trình bày được nguyên tắc điện phân dung dịch, điện phân nóng chảy.
d. Tổ chức hoạt động:
| HOẠT ĐỘNG CỦA GV - HS | DỰ KIẾN SẢN PHẨM |
Bước 1: GV chuyển giao nhiệm vụ học tập - GV giới thiệu thế nào là điện phân.
- HS trình bày về điện phân nóng chảy NaCl.
- GV yêu cầu các nhóm hoàn thành câu Thảo luận 1 (SGK – tr.70) Xác định sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy. - HS trả lời câu hỏi: Nêu nguyên tắc điện phân nóng chảy?
- HS thực hiện Luyện tập (SGK -tr.70) Viết phương trình hoá học của quá trình điện phân nóng chảy các chất: MgCl2, Al2O3. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, vận dụng kiến thức đã học kết hợp đọc thông tin trong SGK để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV. * Trả lời câu hỏi Thảo luận. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận : Nguyên tắc điện phân nóng chảy: • Tại cathode (điện cực âm): xảy ra quá trình khử ion dương. • Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm. - GV chuyển sang nội dung mới. | I. ĐIỆN PHAN NONG CHẢY, DIỆN PHAN DUNG DỊCH - Điện phân là quá trình oxi hoá - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiếu đi qua chất điện li nóng chảy hoặc dung dịch chất điện li. 1. Tìm hiểu nguyên tắc điện phân nóng chảy - Quá trình điện phân NaCl nóng chảy có thể biểu diễn qua sơ đồ sau: 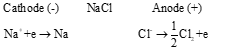 Phương trình hóa học của quá trình điện phân NaCl nóng chảy:
Thảo luận 1 (SGK -tr.70) Khi điện phân NaCl nóng chảy, ở cathode(-) thu được Na, còn ở anode (+) thu được
- Nguyên tắc điện phân nóng chảy: • Tại cathode (điện cực âm): xảy ra quá trình khử ion dương. • Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm. Luyện tập
|
Bước 1: GV chuyển giao nhiệm vụ học tập - GV chia nhóm, HS thực hiện thí nghiệm 1 và trả lời Thảo luận 2, 3, 4 (SGK – tr.71) - GV chú ý: trong quá trình làm thí nghiệm không để hai điện cực chạm vào nhau. 2. Tiến hành Thí nghiệm 1 và nêu hiện tượng quan sát được. 3. Cho biết khi điện phân dung dịch CuSO4, ion Cu2+ và 4. Xác định sản phẩm sinh ra ở mỗi điện cực khi điện phân dung dịch CuSO4, với điện cực trơ. - GV chia nhóm, HS thực hiện thí nghiệm 2 và trả lời Thảo luận 5 (SGK – tr.72) Tiến hành thí nghiệm 2 và nêu hiện tượng xảy ra. Giải thích. - HS thực hiện Luyện tập (SGK -tr.72) Viết quá trình xảy ra ở mỗi điện cực và phương trình hoá học của phản ứng điện phân khi điện phân dung dịch: AgNO3; CuCl2, với điện cực graphite. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, vận dụng kiến thức đã học kết hợp đọc thông tin trong SGK để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV. * Trả lời câu hỏi Thảo luận. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận : nguyên tắc điện phân dung dịch. - GV chuyển sang nội dung mới. | 2. Tìm hiểu nguyên tắc điện phân dung dịch - Thí nghiệm 1: SGK – tr.71.
Thảo luận 2, 3, 4 (SGK -tr.71) 2. Hiện tượng: Ở anode có khí không màu thoát ra, ở cathode có đồng kim loại bám vào. 3. Khi điện phân dung dịch CuSO4, ion Cu2+ di chuyển về điện cực cathode (-) và ion 4. Khi điện phân dung dịch CuSO4, với điện cực trơ, ở cathode (-) thu được Cu, còn ở anode (+) thu được O2, và H2SO4.
- Thí nghiệm 2 (SGK -tr.72) Thảo luận 5 (SGK -tr.72) - Cathode (-) có khí không màu thoát ra, còn anode (+) cũng thu được khí. - Dung dịch thu được có khả năng tẩy màu. 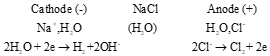 Phương trình hóa học của phản ứng điện phân:
Luyện tập (SGK -tr.72) - Điện phân dung dịch AgNO3, với điện cực graphite: 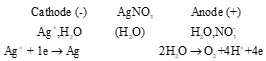 Phương trình hoá học của phản ứng điện phân:
- Điện phân dung dịch CuCl2, với điện cực graphite: 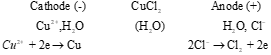 Phương trình hoá học của phản ứng điện phân:
Kết luận: Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn. |
---------------------------------------
------------------ Còn tiếp ------------------------
Ngày soạn:…/…/…
Ngày dạy:…/…/…
BÀI 16. HỢP KIM – SỰ ĂN MÒN KIM LOẠI
I. MỤC TIÊU
1. Về kiến thức
Sau bài học này, HS sẽ:
- Trình bày được khái niệm hợp kim và việc sử dụng phổ biến hợp kim.
- Trình bày được một số tính chất của hợp kim so với kim loại thành phần.
- Nêu được thành phần, tính chất và ứng dụng của một số hợp kim quan trọng của sắt và nhôm (gang, thép, dural,…).
- Nêu được khái niệm ăn mòn kim loại từ sự biến đổi của một số kim loại, hợp kim trong tự nhiên.
- Trình bày được các dạng ăn mòn kim loại và các phương pháp chống ăn mòn kim loại.
- Thực hiện được (hoặc quan sát qua video) thí nghiệm ăn mòn điện hóa đối với sắt và thí nghiệm bảo vệ sắt bằng phương pháp điện hóa, mô tả hiện tượng thí nghiệm, giải thích và nhận xét.
2. Năng lực
Năng lực chung:
- Năng lực giao tiếp và hợp tác: Chủ động giao tiếp trong nhóm, trình bày rõ ý tưởng cá nhân và hỗ trợ nhau hoàn thành nhiệm vụ chung, tự tin và biết kiểm soát cảm xúc, thái độ khi nói trước nhiều người.
- Năng lực giải quyết vấn đề và sáng tạo: Thu thập và làm rõ thông tin có liên quan đến vấn đề; phân tích để xây dựng được các ý tưởng phù hợp.
Năng lực đặc thù:
- Năng lực vận dụng kiến thức, kĩ năng đã học: Nhận ra, giải thích được vấn đề thực tiễn dựa trên kiến thức hoá học.
- Năng lực tìm hiểu tự nhiên dưới góc độ hoá học:
- Sử dụng được ngôn ngữ, hình vẽ, sơ đồ, biểu bảng để biểu đạt quá trình tìm hiểu vấn đề và kết quả tìm kiếm.
- Viết được báo cáo quá trình tìm hiểu.
- Năng lực nhận thức hoá học:
- Trình bày được khái niệm hợp kim và việc sử dụng phổ biến hợp kim.
- Trình bày được một số tính chất của hợp kim so với kim loại thành phần.
- Nêu được thành phần, tính chất và ứng dụng của một số hợp kim quan trọng của sắt và nhôm (gang, thép, dural,…).
- Nêu được khái niệm ăn mòn kim loại từ sự biến đổi của một số kim loại, hợp kim trong tự nhiên.
- Trình bày được các dạng ăn mòn kim loại và các phương pháp chống ăn mòn kim loại.
- Thực hiện được (hoặc quan sát qua video) thí nghiệm ăn mòn điện hóa đối với sắt và thí nghiệm bảo vệ sắt bằng phương pháp điện hóa, mô tả hiện tượng thí nghiệm, giải thích và nhận xét.
3. Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn trọng, trung thực và thực hiện các yêu cầu trong bài học.
- Sử dụng tiết kiệm các nguyên, vật liệu bằng hợp kim.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Đối với giáo viên
- Tài liệu: SGK, SGV Hóa học 12, các hình ảnh liên quan đến bài học.
- Thiết bị dạy học: Máy tính, máy chiếu.
2. Đối với học sinh
- Tài liệu: SGK Hóa học 12.
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu:
- Huy động được vốn hiểu biết, kĩ năng có sẵn của học sinh về hợp kim, sự ăn mòn kim loại để chuẩn bị cho bài học mới; học sinh cảm thấy vấn đề sắp học rất gần gũi với mình.
- Kích thích sự tò mò, khơi dậy hứng thú của học sinh về chủ đề sẽ học; tạo không khí lớp học sôi nổi, chờ đợi, thích thú.
- Học sinh trải nghiệm qua tình huống có vấn đề, trong đó chứa đựng những nội dung kiến thức, những kĩ năng để phát triển phẩm chất, năng lực mới.
b. Nội dung: HS quan sát hình và thực hiện yêu cầu của GV.
c. Sản phẩm: HS phán đoán được kim loại đã xảy ra quá trình oxi hóa hay khử khi bị ăn mòn.
d. Tổ chức thực hiện
Bước 1: GV chuyển giao nhiệm vụ học tập
- GV yêu cầu HS quan sát hình sau.

GV yêu cầu HS dựa vào hình và kiến thức thực tế để trả lời câu hỏi: Em hãy cho biết hiện tượng trong hình. Theo em, kim loại làm thân tàu bị oxi hóa hay bị khử?
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS làm việc cá nhân, suy nghĩ trả lời câu hỏi của GV.
- GV hướng dẫn, hỗ trợ HS (nếu cần thiết).
Bước 3: Báo cáo kết quả hoạt động, thảo luận
- GV mời 2 – 3 HS trả lời câu hỏi: Hiện tượng trong hình là ăn mòn kim loại. Kim loại bị oxi hóa.
- Các HS khác lắng nghe để nhận xét câu trả lời của bạn mình.
- GV khuyến khích HS có thể có nhiều ý kiến khác nhau.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV đánh giá, nhận xét của câu trả lời HS, dẫn dắt HS vào bài học: Thiết bị, vật dụng, công trình làm bằng kim loại thường bị hư hỏng sau một thời gian do sự ăn mòn kim loại. Tuy nhiên, nếu hiểu rõ nguyên nhân của quá trình ăn mòn kim loại, con người có thể giảm thiểu tác động của quá trình ăn mòn. Vậy ăn mòn kim loại là gì? Làm thế nào để chống ăn mòn kim loại? Câu trả lời cho các câu hỏi này sẽ được bật bí trong bài học hôm nay Bài 16 – Hợp kim - Sự ăn mòn kim loại.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1. Tìm hiểu về hợp kim
a. Mục tiêu:
- Trình bày được khái niệm hợp kim và việc sử dụng phổ biến hợp kim.
- Trình bày được một số tính chất của hợp kim so với kim loại thành phần.
- Nêu được thành phần, tính chất và ứng dụng của một số hợp kim quan trọng của sắt và nhôm (gang, thép, dural,…).
b. Nội dung: HS đọc các thông tin trong SGK và thực hiện yêu cầu của GV.
c. Sản phẩm: Câu trả lời của HS về hợp kim, tính chất hợp kim, một số hợp kim quan trọng của sắt và nhôm.
d. Tổ chức hoạt động:
| HOẠT ĐỘNG CỦA GV - HS | DỰ KIẾN SẢN PHẨM |
| Nhiệm vụ 1 : Tìm hiểu khái niệm hợp kim và việc sử dụng hợp kim | |
Bước 1: GV chuyển giao nhiệm vụ học tập - GV cho HS tìm hiểu và trả lời : + Thế nào là hợp kim. Nêu ví dụ. + Thảo luận 1 SGK trang 85: 1.Hãy kể tên một số hợp kim thường gặp trong cuộc sống.
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, vận dụng kiến thức đã học kết hợp đọc thông tin trong SGK để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV. * Trả lời câu hỏi Thảo luận. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về khái niệm hợp kim. - GV chuyển sang nội dung mới. | I. HỢP KIM 1. Khái niệm hợp kim và việc sử dụng hợp kim Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim. Hợp kim có nhiều tính chất cơ học, tính chất vật lí vượt trội so với kim loại, ngày càng được sử dụng phổ biến trong các ngành kinh tế quốc dân. Thảo luận 1 - Thép: Bao gồm các loại như thép carbon, thép không gỉ (inox), thép hợp kim và nhiều loại khác. Chan troi sang tạo - Thép không gỉ: Gọi là thép không gỉ hoặc hợp kim thép không gỉ, ví dụ như thép không gỉ 304 (stainless steel 304) và thép không gỉ 316 (stainless steel 316). - Hợp kim nhôm: Bao gồm các loại như nhôm 6061, nhôm 7075 và nhôm A380. - Hợp kim đồng: Bao gồm các loại như đồng mềm, đồng cứng và đồng nickel. - Hợp kim kẽm: Bao gồm các loại như kẽm nhúng nóng (galvanized), hợp kim kẽm - magnesium (zinc - magnesium alloy) và hợp kim kẽm – thiếc (zinc - tin alloy). - Đồng thau: Còn được gọi là đồng thiếc hoặc hợp kim đồng-thiếc, ví dụ như thau đỏ (phosphor bronze) và thau nickel (nickel silver). - Hợp kim titanium: Bao gồm các loại như titanium grade 5, titanium grade 2 và titanium grade 1. - Hợp kim bạc: Bao gồm các loại như bạc sterling (sterling silver), bạc 925 (silver 925) và bạc đen (black silver). |
| Nhiệm vụ 2 : Tìm hiểu một số tính chất của hợp kim | |
Bước 1: GV chuyển giao nhiệm vụ học tập - GV cho HS tìm hiểu và trả lời : + Thế nào là hợp kim. Nêu ví dụ. + Thảo luận 2 SGK trang 86: 2. Nêu một số ví dụ về tính chất của hợp kim mà em biết.
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, vận dụng kiến thức đã học kết hợp đọc thông tin trong SGK để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV. * Trả lời câu hỏi Thảo luận. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận : Hợp kim có nhiều tính chất hoá học tương tự tính chất hoá học của các đơn chất thành phần, tuy nhiên tính chất vật lí và tính chất cơ học của hợp kim khác so với tính chất của các đơn chất thành phần. - GV chuyển sang nội dung mới. | 2. Một số tính chất của hợp kim - Tính chất của hợp kim phụ thuộc vào thành phần của nó. Nhiều hợp kim rất bền dù ở nhiệt độ cao, ít bị ăn mòn; hợp kim thường cứng hơn các đơn chất thành phần; độ dẫn điện, dẫn nhiệt của hợp kim thường kém hơn độ dẫn điện, dẫn nhiệt của đơn chất thành phần; ... Ví dụ 1 (SGK -tr.86) Thảo luận 2 - Độ cứng và độ dẻo: Hợp kim có thể có độ cứng và độ dẻo khác nhau so với kim loại tinh khiết. Sự tạo thành liên kết và cấu trúc tinh thể phức tạp trong hợp kim có thể làm tăng độ cứng hoặc độ dẻo tuỳ thuộc vào thành phần và cấu trúc của hợp kim đó. - Độ dẫn điện và độ dẫn nhiệt: Hợp kim có thể có khả năng dẫn điện và dẫn nhiệt khác so với kim loại tinh khiết. Sự có mặt của các nguyên tố khác trong hợp kim có thể ảnh hưởng đến khả năng dẫn điện và nhiệt của nó. |
| Nhiệm vụ 3: Tìm hiểu thành phần, tính chất và ứng dụng một số hợp kim quan trọng của sắt và nhôm | |
Bước 1: GV chuyển giao nhiệm vụ học tập - GV cho HS tìm hiểu và trả lời : + Thế nào là hợp kim. Nêu ví dụ. + Thảo luận 3 SGK trang 86: 3. Hãy so sánh thành phần, tính chất và ứng dụng của gang và thép.
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, vận dụng kiến thức đã học kết hợp đọc thông tin trong SGK để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV. * Trả lời câu hỏi Thảo luận. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận : Hợp kim của sắt thường cứng, được dùng phổ biến trong các công trình xây dựng. Các hợp kim của nhôm nhẹ, màu trắng bạc nên dùng phổ biến trong lĩnh vực hàng không, trang trí nội thất, ... - GV chuyển sang nội dung mới. | 3. Thành phần, tính chất và ứng dụng một số hợp kim quan trọng của sắt và nhôm - Hợp kim của sắt: + Gang là hợp kim của Fe và C (2% – 5% về khối lượng) và chứa một lượng nhỏ các nguyên tố khác: Si, S, Mn, P, ... + Thép là hợp kim của Fe và C (2% về khối lượng) và một số nguyên tố khác như: Si, Mn, Cr, Ni, ... (Bảng 16.1).
Hợp kim của nhôm - Dural (duralumin) với thành phần chính là Al, Cu và một số nguyên tố khác như Mg, Mn, Fe, Si, ... . Ưu điềm là nhẹ, bền trong không khí và nước nên được sử dụng làm vật liệu chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ, ... - Hợp kim nhôm có màu trắng bạc, đẹp nên được sử dụng làm khung cửa và trang trí nội thất. Thảo luận 3 (Bảng dưới)
|
Thảo luận 3 : So sánh thành phần, tính chất và ứng dụng của gang và thép.
| Giống nhau | Khác nhau | ||
| Gang | Thép | ||
| Thành phần | Là hợp kim của Fe và C | C chiếm khoảng 2% - 5% | C chiếm dưới 2% |
| Tính chất |
| Gang cứng giòn, không thể uốn hay kéo thành sợi; | Thép có tính chất cứng, bền, dẻo, ... Có loại thép bị gỉ trong không khí ẩm nhưng cũng có loại thép không bị gỉ. |
| Ứng dụng | Gang cứng, chống ăn mòn cao nên thường được dùng để làm thiết bị gia dụng nhà bếp, nội thất hoặc các chi tiết máy cố định. | Thép nhờ tính giãn nở khi nhiệt độ thay đổi, độ đàn hồi tốt nên thường được sử dụng để làm nguyên liệu sản xuất cho các vật dụng có hình dạng không quá phức tạp hoặc các thiết bị chịu nhiệt, chịu lực. Thép thường được sử dụng để làm hệ khung nhà vì khả năng chịu nhiệt, chịu lực và tải trọng tốt. Bên cạnh đó, gang xám thường được dùng để làm máng dẫn hoặc ống dẫn nước trong các công trình yêu cầu trình độ kĩ thuật phức tạp. | |
--------------------------------------
--------------------- Còn tiếp ----------------------
II. TRẮC NGHIỆM KÌ 2 HÓA HỌC 12 CHÂN TRỜI SÁNG TẠO
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 12: Thế điện cực và nguồn điện hoá học
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 13: Điện phân
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 14: Đặc điểm cấu tạo và liên kết kim loại. Tính chất kim loại
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 15: Các phương pháp tách kim loại
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 16: Hợp kim – Sự ăn mòn kim loại
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 17: Nguyên tố nhóm IA
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 18: Nguyên tố nhóm IIA
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 19: Đại cương về kim loại chuyển tiếp dãy thứ nhất
- Phiếu trắc nghiệm Hoá học 12 chân trời Bài 20: Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
CHƯƠNG 5. PIN ĐIỆN VÀ ĐIỆN PHÂN
BÀI 13. ĐIỆN PHÂN
A. TRẮC NGHIỆM
1. NHẬN BIẾT (10 câu)
Câu 1: Trong quá trình điện phân dung dịch NaCl (điện cực trơ có màng ngăn), ở cực âm (cathode) xảy ra
A. sự oxi hoá cation Na+.
B. sự oxi hoá phân tử H2O.
C. sự khử phân tử H2O.
D. sự khử cation Na+.
Câu 2: Khi điện phân NaCl nóng chảy (điện cực trơ), tại cathode xảy ra
A. sự khử ion Cl-.
B. sự oxi hoá ion Cl-.
C. sự oxi hoá ion Na+.
D. sự khử ion Na+.
Câu 3: Khi điện phân CaCl2 nóng chảy (điện cực trơ), tại cực dương xảy ra
A. sự khử ion .
B. sự khử ion Ca2+.
C. sự oxi hoá ion Ca2+.
D. sự oxi hoá ion .
Câu 4: Sự điện phân là quá trình
A. Oxi hóa – khử.
B. Oxi hóa.
C. Khử.
D. Điện ly.
Câu 5: Trong các dung dịch điện phân điện phân, các ion mang điện tích âm là
A. gốc acid và ion kim loại.
B. gốc acid và ion hydroxide.
C. ion kim loại và base.
D. chỉ có ion hydroxide.
Câu 6: NaCl và KOH đều là chất điện phân. Khi tan trong dung dịch điện phân thì
A. Na+ và K+ là cation
B. Na+ và OH- là cation
C. Na+ và Cl- là cation
D. OH- và Cl- là cation
Câu 7: Hiện tượng điện phân không ứng dụng để
A. đúc điện
B. mạ điện
C. sơn tĩnh điện
D. luyện nhôm
Câu 8: Điện phân nóng chảy NaCl, ở cathode thu được chất nào sau đây?
A. HCl.
B. Cl2.
C. Na.
D. NaOH.
Câu 9: Khi điện phân nóng chảy của KCl, chất nào sau đây được tạo ra ở cực dương?
A. K
B. Cl
C. Cl2
D. KCl
Câu 10: Điện phân dung dịch NaCl được sử dụng để sản xuất chất nào dưới đây?
A. NaOH
B. H2SO4
C. NH3
D. H2O2
2. THÔNG HIỂU (10 câu)
Câu 1: Sản phẩm thu được khi điện phân dung dịch KCl (điện cực trơ, màng ngăn xốp) là
A. K và Cl2.
B. K, H2 và Cl2.
C. KOH, H2 và Cl2.
D. KOH, O2 và HCl.
--------------------------------------
--------------------- Còn tiếp ----------------------
CHƯƠNG 6. ĐẠI CƯƠNG KIM LOẠI
BÀI 16. HỢP KIM - SỰ ĂN MÒN KIM LOẠI
A. TRẮC NGHIỆM
1. NHẬN BIẾT (10 câu)
Câu 1: Hợp kim là gì?
A. Một loại nguyên tố hóa học
B. Một hỗn hợp đồng nhất của hai hoặc nhiều nguyên tố, trong đó ít nhất một là kim loại,
C. Một phản ứng hóa học giữa hai kim loại
D. Một dạng tinh thể của kim loại đơn chất
Câu 2: Hợp kim nào sau đây có tính chất chống ăn mòn cao và thường được sử dụng trong môi trường biển?
A. Thép carbon
B. Đồng thau
C. Thép không gỉ
D. Gang
Câu 3: Sự phá huỷ kim loại do kim loại tác dụng trực tiếp với các chất oxi hoá trong môi trường gọi là
A. sự khử kim loại.
B. sự tác dụng của kim loại với nước.
C. sự ăn mòn hoá học.
D. sự ăn mòn điện hoá.
Câu 4: Phát biểu nào sau đây là không đúng?
A. Ăn mòn kim loại là sự phá huỷ kim loại và hợp kim dưới tác dụng của môi trường xung quanh.
B. Ăn mòn kim loại là một quá trình hoá học trong đó kim loại bị ăn mòn bởi các axit trong môi trường không khí.
C. Trong quá trình ăn mòn, kim loại bị oxi hoá thành ion của nó.
D. Ăn mòn kim loại được chia làm 2 dạng: ăn mòn hoá học và ăn mòn điện hoá học.
Câu 5: Gang là hợp kim của sắt (iron) với carbon và một lượng nhỏ các nguyên tố khác như: Si, Mn, S,… trong đó hàm lượng carbon chiếm:
A. Từ 2% đến 6%.
B. Dưới 2%.
C. Từ 2% đến 5%.
D. Trên 6%.
Câu 6: Thép là hợp kim của sắt (iron) với carbon và một số nguyên tố khác trong đó hàm lượng carbon chiếm:
A. Trên 2%.
B. Dưới 2%.
C. Từ 2% đến 5%.
D. Trên 5%.
Câu 7: Trong hợp kim đuyra, nguyên tố chiếm hàm lượng cao nhất là
A. Mg.
B. Al.
C. Mn.
D. Cu.
Câu 8: Tính chất đặc trưng của inox là
A. nhẹ và bền.
B. độ cứng cao.
C. khó bị gỉ.
D. dẫn điện tốt.
Câu 9: Tính chất đặc trưng của đuyra là
A. nhẹ và bền.
B. độ cứng cao.
C. khó bị gỉ.
D. dẫn điện tốt.
Câu 10: Phát biểu nào sau đây không đúng?
A. tất cả các kim loại đều điều chế được bằng phương pháp điện phân nóng chảy.
B. hợp kim thường có nhiều tính chất ưu việt hơn các kim loại tạo ra nó.
C. hợp kim đuy-ra nhẹ và bền được dùng sản xuất vỏ máy bay, khung xe đạp, …
D. hợp kim inox khó bị gỉ được dùng làm dụng cụ nấu ăn, dụng cụ phẫu thuật, …
2. THÔNG HIỂU (8 câu)
Câu 1: Thí nghiệm nào sau đây Fe chỉ bị ăn mòn hóa học?
A. Đốt cháy dây sắt trong không khí khô.
B. Cho hợp kim Fe – Cu vào dung dịch CuSO4.
C. Để mẩu gang lâu ngày trong không khí ẩm.
D. Cho Fe vào dung dịch AgNO3.
--------------------------------------
--------------------- Còn tiếp ----------------------

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hoá học 12 chân trời sáng tạo
Từ khóa: giáo án kì 2 Hoá học 12 chân trời sáng tạo, bài giảng kì 2 môn Hoá học 12 chân trời sáng tạo, tài liệu giảng dạy Hoá học 12 chân trời sáng tạo
